
| V |
| Vm |
| N |
| NA |
| m |
| M |
| 8.96L |
| 22.4L/mol |
| 14g |
| 28g/mol |
| 11g |
| 44g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、原混合液中NO3-的物质的量为0.2mol |
| B、OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气 |
| C、溶液中最终溶质为FeSO4 |
| D、c(H2SO4)为5mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.05 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.10 mol?L-1 |
| D、0.50 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①③⑤ |
| C、②④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、Z三种元素在周期表中的位置依次是ⅦA、ⅥA、ⅤA |
| B、原子半径X>Y>Z |
| C、元素原子的得电子能力X>Y>Z |
| D、气态氢化物的化学式依次是HX、H2Y、ZH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
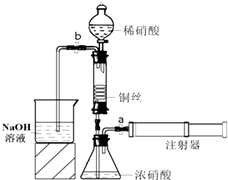 某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下:
某同学利用如图装置实现铜与浓、稀硝酸反应,过程如下:| 实验编号 | 水温/℃ | 液面上升高度 | ||
| 1 | 25 | 超过试管
| ||
| 2 | 50 | 不足试管
| ||
| 3 | 0 | 液面上升超过实验1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com