
【题目】用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断段化学反应速率最快,段收集的氢气最多. 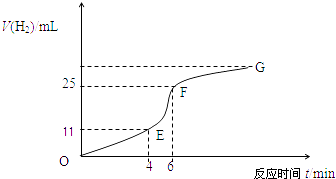
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是 , 一定时间后反应速率逐渐减慢,其原因是 .
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸
E.降低温度
(4)EF段产生H2的反应速率为mLmin﹣1 .
【答案】
(1)EF;EF
(2)该反应是放热反应,温度升高,反应速率加快;随着反应的进行,盐酸的浓度逐渐减小,反应速率逐渐减小
(3)ACE
(4)7.0
【解析】解:(1.)根据纵坐标的高低判断收集气体的多少,纵坐标越高,收集的气体越大,所以是EF段;根据图象斜率判断反应速率的大小,斜率越大,反应速率越快,所以是EF段,所以答案是:EF段;EF段;
(2.)影响EF段速率变化主要因素是:该反应是放热反应,温度越高,反应速率越快,所以温度的改变是改变反应速率的主要原因;影响FG段速率变化主要因素是:随着反应的进行,盐酸的浓度逐渐减小,浓度越小,反应速率越小,所以浓度的改变是改变反应速率的主要原因;所以答案是:该反应是放热反应,温度升高,反应速率加快;随着反应的进行,盐酸的浓度逐渐减小,反应速率逐渐减小.
(3.)反应物的浓度越大,反应速率越快,所以只要使反应物浓度变小即可.
A、加蒸馏水,盐酸浓度变小,反应速率减小,故A正确;
B、加氯化钠固体,盐酸浓度不变,反应速率不变,故B错误;
C、加氯化钠溶液,溶液体积增大,盐酸浓度降低,反应速率减小,故C正确;
D、加浓盐酸,盐酸浓度增大,反应速率加快,故D错误;
E、温度降低,化学反应速率减小,故E正确;所以答案是:ACE;
(4.)因V= ![]() =
= ![]() =7.0mlmin﹣1 , 所以答案是:7.0.
=7.0mlmin﹣1 , 所以答案是:7.0.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分别向2L 0.5molL﹣1的KOH的溶液中加入适量的①浓硫酸、②稀醋酸、③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是( )
A.△H1<△H3<△H2
B.△H1>△H2>△H3
C.△H1>△H2=△H2
D.△H1<△H2<△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A. 2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C. CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D. FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法正确的是
①用蒸馏法分离乙醇和水的混合物②用过滤的方法分离二氧化锰和碳酸钙
③用乙醇萃取碘水中的碘:④用蒸发溶剂的方法可以从氯化钠溶液中得到氯化钠的晶体
A. ①和② B. ②和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有毒气体的减排和处理是工业生产中的重要课题。
(1)Na2CO3溶液可吸收尾气SO2,反应过程中溶液组成变化如下图。

①SO2分子属于________ (选填“极性”或“非极性”) 分子,以上反应_____(选填“能”或“不能”) 说明S、C两种元素的非金属性强弱。
②A点反应的离子方程式是_____。
(2)汽车发动机稀燃控制系统主要工作原理是发动机在稀燃和富燃条件下交替进行,尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:

①已知Ba(NO3)2分解产物含有两种气体,由上图信息,写出Ba(NO3)2分解反应的化学方程式_______。
②下列说法正确的是__________
A.稀燃过程的目的是固氮
B.在整个过程中,Pt和BaO都可看作催化剂
C.汽车尾气若不处理,其中的氮氧化物等可能形成光化学烟雾
D.富燃过程中,NO2与CO反应,氧化产物和还原产物的物质的量之比为1:1
③实验测出,每千克CxHy (以液体C8H18为例) 在O2中充分燃烧生成液态水,放出4.78×104kJ热量。写出C8H18燃烧热的热化学反应方程式______________。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+ H2O =2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①下图是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为_______%。
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=5 :3时,可通入一定量的空气,同温同压下,V(空气): V(NO)=___________ (空气中氧气的体积含量大约为20%)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫铁矿制硫酸的说法中,正确的是( )
A.沸腾炉中出来的炉气,可直接进入转化器中进行催化氧化
B.焙烧硫铁矿的反应中,二氧化硫是唯一的氧化产物
C.生产过程中要采用高温高压,以有利于二氧化硫更好地转化为三氧化硫
D.三氧化硫在吸收塔中被吸收时,通常用质量分数为98.3%的硫酸做吸收剂,而不直接用水吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制药厂尾气中含少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境。分别用0.1 mol·L-1的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是( )
A.NaOH溶液的体积大于氨水
B.NaOH溶液的体积等于氨水
C.NaOH溶液的体积小于氨水
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com