
【题目】下列图示与对应的叙述相符的是( )
A.
图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJmol﹣1
B.
图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.
图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D.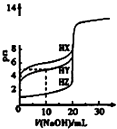
图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
【答案】C
【解析】解:A.整个反应中△H=(E1﹣E2)+(E2﹣E3)﹣E4=E1﹣E3﹣E4 , 故A错误;
B.如果t2时扩大容器的体积,则各种物质的浓度瞬间变小,浓度曲线不是连续的,故B错误;
C.NaOH溶液呈碱性对水的电离起抑制作用,水电离氢离子浓度较小,通入二氧化碳,氢氧化钠的浓度减小,对水的抑制程度较小,水电离的氢离子浓度增大,当二氧化碳过量时,二氧化碳与水反应生成碳酸又抑制水的电离,水电离的氢离子浓度减小,与图象相符合,故C正确;
D.氢氧化钠体积为0时,0.1000molL﹣1的三种酸HX、HY、HZ的PH分别约为4、2.5、1,故酸性大小为HX<HY<HZ,故D错误;
故选C.
A.A→B的反应,反应物总能量小于生成物总能量,反应吸热,B→C的反应,反应物的总能量大于生成物总能量,反应为放热反应,结合能量的高低解答该题;
B.依据图象各种物质的物质的量浓度的变化分析,改变条件后各种物质的浓度曲线是连续渐变的据此分析;
C.分析图象可知水电离产生的氢离子浓度先增加后减小,说明二氧化碳通入的过程中先产生了促进水电离的物质,后又生成了抑制水的电离的物质,结合水的电离平衡的影响因素解答;
D.依据浓度相同的三种一元酸未加氢氧化钠溶液时pH值的大小可判断酸性的强弱.


科目:高中化学 来源: 题型:
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.某兴趣小组的实验数值结果大于57.3kJmol﹣1(中和热),原因可能是( ) 
A.实验装置中小烧杯杯中低于大烧杯杯口
B.用浓硫酸代替了稀硫酸
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示

则下列说法错误的是
A. 醋酸的电离程度:a<b<c
B. 溶液的pH值:b<a<c
C. 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大
D. 若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:

(1)黄铜矿中Cu 的化合价是______,反应I中65gFeC13 可氧化________mol CuFeS2。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有______。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3mol/L)可产生FeCO3沉淀时的最小Fe2+浓度是_________(己知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________。
(5)固体物质A的成分________(写名称)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:_______________。
(7)本流程中可实现循环使用的物质除了水外,还有_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
2Pb(BF4)2+2H2O,Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,负极反应为:PbO2+4HBF4-2e-=Pb(BF4)2+2BF4-+2H2O
B. 充电时,当正极质量减少23.9g时转移0.2mol电子
C. 放电时,PbO2电极附近溶液的pH增大
D. 充电时,Pb电极的电极反应式为PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的X,Y,Z三种酸的溶液各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的变化关系如图所示,下列说法错误的是( ) 
A.X是强酸,Y和Z是弱酸
B.稀释前的浓度大小为c(Z)>c(Y)>c(X)
C.稀释前电离程度大小为X>Y>Z
D.pH=2时,X,Y,Z都是稀溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于在恒容密闭容器中进行的反应:2SO2(g) +O2(g)2SO3(g), 下列叙述能充分说明该反应已经达到化学平衡状态的是( )
A.正、逆反应速率都等于零B.SO2、O2、SO3的浓度相等
C.SO2、O2、SO3在容器中共存D.SO2、O2、SO3的浓度均不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com