
【题目】如图表示反应M(g)+P(g) ![]() nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )
nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )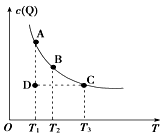
A.通过分析题图,该反应的正反应为放热反应
B.A状态与C状态的化学反应速率比较为v(A)<v(C)
C.在T1、D状态时,v正<v逆
D.在T2、B状态时,改变体积始终有v正=v逆 , 则n=2
【答案】C
【解析】A.图象分析可知随温度升高,Q的浓度减小,说明平衡逆向进行,依据平衡移动原理分析,逆向是吸热反应,所以正反应是放热反应,A不符合题意;
B.化学反应速率影响因素分析,温度越高反应速率越大,A状态与C状态的化学反应速率比较为v(A)<v(C),B不符合题意;
C.图象分析D状态不是平衡状态,达到平衡需要增大Q的浓度,平衡正向进行,v正>v逆 , C符合题意;
D.在T2、B状态时,改变体积,压强变化,平衡不动说明反应前后气体体积不变,n=2,D不符合题意;
故答案为:CA.由图可知,温度升高,生成物的浓度减小,结合温度对平衡移动的影响分析;
B.温度越高,反应速率越快;
C.在T1、D状态时,平衡向正反应方向进行,据此判断正逆反应速率的大小;
D.在T2、B状态时,体积改变,压强改变,结合压强对平衡移动的影响分析;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如下图所示。下列说法正确的是( )
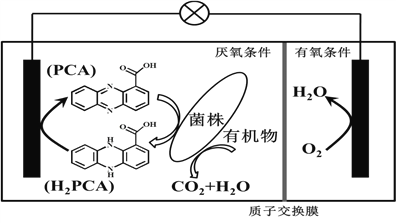
A. 电流由左侧电极经过负载后流向右侧电极
B. 放电过程中,正极附近pH 变小
C. 若1molO2 参与电极反应,有4 mol H+穿过质子交换膜进入右室
D. 负极电极反应为:H2PCA + 2e-=PCA + 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
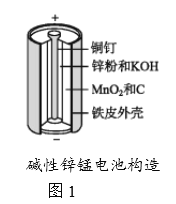
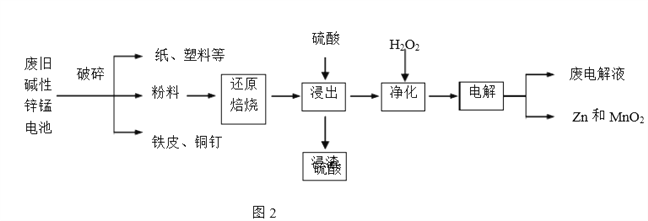
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图1所示。放电时总反应为Zn+2H2O+2MnO2![]() Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
Zn(OH)2+2MnOOH,从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下图2所示:
回答下列问题:
(1)碱性锌锰电池中,锌粉、MnO2、KOH的作用分别是(每空只选1个)_______、_______ 、______。
a.正极反应物b. 正极材料 c.负极反应物
d. 负极材料 e. 电子导体 f. 离子导体
(2)“还原焙烧”过程中,无需外加还原剂即可在焙烧过程中将MnOOH、MnO2还原为MnO,起还原作用的物质是___________。
(3)“净化”是在浸出液中先加入H2O2,再加入碱调节溶液pH到4.5左右,再过滤出沉淀。请完整说明这样操作的目的是______________。
Zn(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀的pH | 5.5 | 1.9 | 8.0 |
沉淀完全的pH | 8.0 | 3.2 | 10.0 |
(4) “电解”时,阳极的电极反应式为___。本工艺中应循环利用的物质是____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为_____。
(6)某碱性锌锰电池维持电流0.5 A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有____%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸H2A在水中存在下列电离:①H2A=H++HA- ②HA- ![]() H++A2- , 下列说法一定正确的是( )
H++A2- , 下列说法一定正确的是( )
A.Na2A溶液中一定有:c(OH-)= c(H+)+c(HA-)
B.Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性
C.Na2A溶液中一定有c(Na+)+c(H+)= c(OH-)+c(A2-) +c(HA-)
D.NaHA溶液一定有c(Na+)>c(HA) >c(OH-)>c(H2A) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是

A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1.0mol/L 盐酸滴入20mL 10mol/L氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示。下列有关说法正确的是
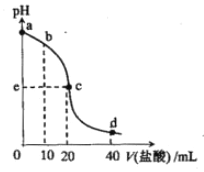
A. a点,c(NH4+)=c(OH-)
B. b点,c(NH4+)>c(Cl-)>c(NH3·H2O)
C. c点,pH=7
D. d点,c(NH4+)+c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的MgSO4溶液时,下列情况可能导致实际浓度偏高的是( )
A.称量时部分MgSO4吸收了水蒸气
B.定容时俯视容量瓶上的刻度线
C.洗涤后的容量瓶中有少量水珠
D.溶解过程中有少量的溶液溅出烧杯外
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com