
| A. | 7.1 g 37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78 g | |
| C. | 7.8 g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24 L己烷含有的共价键数为1.9NA |
分析 A.1个37Cl含有20个中子;
B.1个个Al(OH)3胶体粒子,含有多个Al(OH)3;
C.过氧化钠阳离子为钠离子,阴离子为过氧根离子;
D.气体摩尔体积使用对象为气体.
解答 解:A.7.1 g 37Cl2物质的量为$\frac{7.1g}{74g/mol}$<0.01mol,含有的中子数小于4NA,故A错误;
B.NA个Al(OH)3胶体粒子的质量大于78 g,故B错误;
C.7.8 g Na2O2晶体物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,含有0.2mol钠离子和0.1mol过氧根离子,共含有阴阳离子总数为0.3NA,故C正确;
D.气体摩尔体积使用对象为气体,标况下己烷为液体,不能使用气体摩尔体积,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算及应用,掌握以物质的量的为核心计算公式和物质结构是解题关键,难度不大,注意气体摩尔体积使用对象为气体.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| 物质性质 | 实际应用 | |
| A | 硅胶吸水能力强 | 食品、药品干燥剂 |
| B | 油脂在碱性条件下水解 | 制肥皂 |
| C | SiO2是酸性氧化物 | 光导纤维 |
| D | Na2O2与CO2、H2O反应 | 潜水艇中作为氧气来源 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>W>X | |
| B. | 气态氢化物的热稳定性:X>W | |
| C. | 工业上常用电解对应氯化物的方法制备单质 Z | |
| D. | Y 的最高价氧化物对应的水化物可溶于氯化铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的电子式为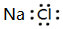 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为:ClO-+CH3COOH=HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 根据实验现象可以判断电解时阳极的电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做“钠与水的反应”实验时.切取绿豆大小的金属钠,用滤纸吸干表面煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置;下层液体显紫红色;则氧化性:Fe3+>I2 | |
| C. | 测定等浓度的Na2CO3和Na2SO3 溶液的pH;前者pH 比后者的大;则非金属性:S>C | |
| D. | 溴乙烷与 NaOH 溶液共热后,加入AgNO3溶液;未出现淡黄色沉淀;说明溴乙烷没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
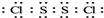 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
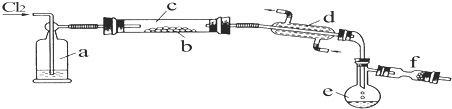
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2•t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com