
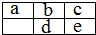
 短周期非金属元素a,b,c,d,e在元素周期表中的相对位置如右表所示(留空位置为金属元素),下列判断错误的是( )
短周期非金属元素a,b,c,d,e在元素周期表中的相对位置如右表所示(留空位置为金属元素),下列判断错误的是( )| A、简单阴离子半径:e>b>c | B、单质的氧化性:c>e | C、最外层电子数:a>d>c | D、氢化物的沸点:b<c |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:
 物质结构与性质
物质结构与性质查看答案和解析>>
科目:高中化学 来源: 题型:


| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2012届福建省福州市高三第一学期期末质量检查考试化学试卷 题型:填空题
(8分)四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是 。
(2)化合物CA3的电子式是 ,BD2分子的结构式为 。
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com