
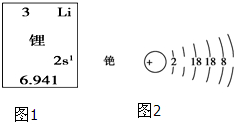
 碱金属元素在科学研究与生产生活中有着非常广泛的用途.
碱金属元素在科学研究与生产生活中有着非常广泛的用途. ,故答案为:
,故答案为: ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA |
| B、1 L 0.1 mol.L-1的醋酸溶液中氢离子数为0.1 NA |
| C、以惰性电极电解NaCl溶液时,每放出11.2LCl2时,则消耗NaCl个数为NA |
| D、在密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、Mg(HCO3)2溶液与过量NaOH:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- |
| D、次氯酸钙与亚硫酸:Ca2++2ClO-+H2SO3=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
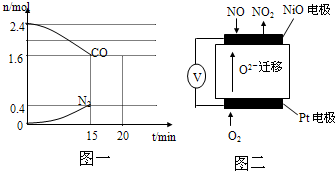
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
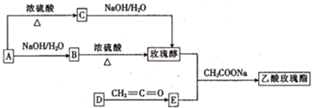
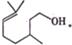

查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓度 时间(秒) 反应条件 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2无催化剂、加热 | 10 | 25 | 60 | 120 |
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
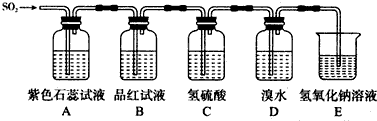
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B、基态Fe原子的外围电子排布图为: |
| C、因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D、根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com