
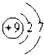
 ,第一电离能最小的元素的原子轨道表达式
,第一电离能最小的元素的原子轨道表达式 .
.分析 (1)同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族;
(2)第四周期元素中,4p轨道半充满说明4p轨道中含有3个电子;根据核外电子排布规律,先排4S后排3d,价电子层中S电子数与d电子数相同的元素是钛;
(3)由化学方程式为S+2KNO3+3C→X+N2↑+3CO2↑,根据质量守恒定律可知,反应前后元素种类、原子个数相等,则A的化学式为K2S,
①同周期元素从左到右元素的非金属性逐渐增强,对应的气态氢化物稳定性逐渐增强;
②处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则书写,K为19号元素.
解答 解:(1)同一周期元素的第一电离能随着原子序数的增大而增大,所以在第二周期中(稀有气体除外),第一电离能最大的元素F,原子结构示意图为 ,第一电离能最小的元素为Li,原子核外电子排布为1S22S1,轨道式为
,第一电离能最小的元素为Li,原子核外电子排布为1S22S1,轨道式为 ,
,
故答案为: ;
; ;
;
(2)第四周期元素中,4p轨道半充满说明4p轨道中含有3个电子,根据电子排布规则知,该原子的3d、4s能级上都充满电子,所以该基态原子的核外电子排布式为:[Ar]3d104s24p3,所以为As元素;价电子层中S电子数与d电子数相同,因s轨道最多排2个电子,且排满S再排d,所以d电子数为2,Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,符合条件,
故答案为:As;钛;
(3)由化学方程式为S+2KNO3+3C→X+N2↑+3CO2↑,根据质量守恒定律可知,反应前后元素种类、原子个数相等,则A的化学式为K2S,
①除K、S外,上述方程式中出现的元素有C、N、O,元素C、N、O属于同一周期元素且原子序数依次增大,氢化物的稳定性从大到小依次为H2O>NH3>CH4,
故答案为:H2O>NH3>CH4;
②钾元素为19号元素,原子核外有19个电子,所以核外电子排布式为:1s22s22p63s23p64s1,
故答案为:1s22s22p63s23p64s1.
点评 本题考查了第一电离能大小的判断、核外电子排布等知识,题目难度不大,根据元素周期律来分析解答即可,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.01mol/(L•S) | B. | v(B)=0.02mol/(L•S) | C. | v(B)=0.60mol/(L•S) | D. | v(C)=1.0mol/(L•S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物与还原产物粒子个数比是2:5 | |
| B. | 被氧化的盐酸占参加反应盐酸总数的$\frac{5}{8}$ | |
| C. | KMnO4只有一部分发生还原反应 | |
| D. | KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
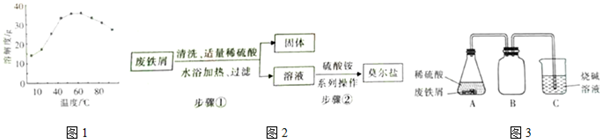
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
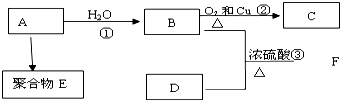
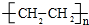 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中电子流出的极为负极,发生氧化反应 | |
| B. | 原电池中阴离子向正极移动 | |
| C. | 原电池是将电能转化为化学能的装置 | |
| D. | 原电池正极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的熔点:石英>食盐>冰>汞 | |
| B. | 热稳定性:PH3>H2S>HBr>NH3 | |
| C. | 微粒半径由大到小顺序是:H->Li+>H+ | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com