
| A. | 沉淀中氢氧根的质量为5.1g | B. | V为2.24L | ||
| C. | Cu的物质的量为0.1mol | D. | 反应后溶液呈中性 |
分析 反应后的溶液中加入足量氢氧化钠溶液,金属元素全部沉淀,得到的沉淀是Cu(OH)2和Mg(OH)2的混合物,质量增加量为沉淀中OH-的质量,计算氢氧根的物质的量,由电荷守恒可知,金属提供电子等于沉淀中氢氧根的物质的量,采用极值法计算:假设得到的气体全是NO,假设得到的气体全是NO2,根据电子转移守恒计算气体物质的量,再计算生成气体体积,混合气体体积在二者之间;设混合物中Cu、Mg的物质的量分别为x、y,则根据质量可得64x+24y=5.6g,根据电子守恒可得2x+2y=0.3mol,据此计算出铜的物质的量.
解答 解:反应后的溶液中加入足量氢氧化钠溶液,金属元素全部沉淀,得到的沉淀是Cu(OH)2和Mg(OH)2的混合物,质量增加量为沉淀中OH-的质量,所以m(OH-)=10.7g-5.6g=5.1g,则n(OH-)=$\frac{5.1g}{17g/mol}$=0.3 mol,由电荷守恒可知,金属提供电子等于沉淀中氢氧根的物质的量,即Cu、Mg共失去0.3 mol电子,
A.根据分析可知,沉淀中氢氧根的质量为5.1g,故A正确;
B.假设得到的气体全是NO,由电子转移守恒可知,n(NO)=$\frac{0.3mol}{5-2}$=0.1mol,所以NO体积是:0.1 mol×22.4 L/mol=2.24 L,
假设得到的气体全是NO2,由电子转移守恒可知,n(NO2)=$\frac{0.3mol}{5-4}$=0.3mol,所以NO2体积是:0.3 mol×22.4 L/mol=6.72 L,
因为得到是混合气体,因此体积在二者之间,即2.24<V<6.72,故B错误;
C.设混合物中Cu、Mg的物质的量分别为x、y,则64x+24y=5.6g、2x+2y=0.3mol,解得:0.05mol、y=0.1mol,即:铜的物质的量为0.05mol,故C错误;
D.反应后生成硝酸镁、硝酸铜,铜离子部分水解,溶液呈酸性,故D错误;
故选A.
点评 本题考查了混合物反应计算,题目难度中等,利用守恒思想计算,避免难以确定Fe反应后的价态,明确氢氧根离子所带电荷等于金属失去的电子为解答关键,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量水解液加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
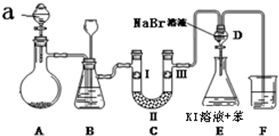
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
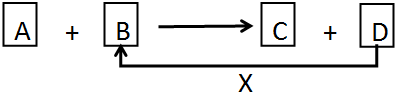
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述灼烧过程的尾气均可直接排到空气中 | |
| B. | 由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2中,作氧化剂的只有Cu2O | |
| D. | 电解精炼时,粗铜应与外电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物的名称为2-甲基-5-乙基己烷 | |
| B. | 淀粉、纤维素、蛋白质、油脂都是高分子化合物,一定条件下都能发生水解反应 | |
| C. | 在蛋白质溶液中加入硫酸铜溶液和福尔马林,均能使蛋白质变性,失去生理功能 | |
| D. | CH3COOCH2CH3与CH3CH2CH2COOH互为同分异构体,乙醛和苯甲醛互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

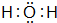 D 的原子结构示意图
D 的原子结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com