
����Ŀ��ʵ������������ƿ�м�NaBr������ˮ��95%���Ҵ���Ũ���ᣬ�þƾ��ƶ���ƿ�ȣ��߷�Ӧ��������������������ˮ���ռ�����á����п��ܷ����ĸ���Ӧ�У�2HBr+H2SO4��Ũ����Br2+SO2![]() +2H2O
+2H2O
���������գ�
��1���Ʊ�������Ļ�ѧ����ʽΪ��_________��_______��
��2����Ӧ�м�������ˮ���ܲ�����������__________��ѡ���ţ�
A ��ֹ�����鱻Ũ�������� B �����廯��Ļӷ�
C ʹ��Ӧ�����ֲ� D �ܽ��廯��
��3��Ϊ�˱�֤�����������ȺͿ��ƺ��£����ȷ�����ò���________��
��4�����ñ߷�Ӧ������IJ�����ƣ�����ҪĿ����_________��
��5�����������ˮ���ռ�����õ�������___________��
��6������װ����ʵ���м�������HBr���壬���ܷ�ֹҺ�嵹������__________��ѡ���ţ�
��7���ֲ�Ʒ��ˮϴ�Ӻ��л����Գʺ���ɫ������ȥ�����ʣ��ɼ�����Լ�Ϊ________��ѡ���ţ�
A �⻯����Һ B ����������Һ C ����������Һ
��8�����²��裬�����ڼ�������������Ԫ�أ�����ȷ�IJ���˳���ǣ�ȡ���������飬Ȼ��_______��
���𰸡�NaBr+H2SO4![]() NaHSO4+HBr C2H5OH+HBr
NaHSO4+HBr C2H5OH+HBr![]() C2H5Br+H2O C ˮԡ���� ʹ��Ӧƽ�������ƶ�����߲���IJ��� ������������ˮ���ܶȱ�ˮ�� A B ����������������ˮ��Һ�����ȣ���ȴ����������ϡ���ᣬ�ټ�����������Һ
C2H5Br+H2O C ˮԡ���� ʹ��Ӧƽ�������ƶ�����߲���IJ��� ������������ˮ���ܶȱ�ˮ�� A B ����������������ˮ��Һ�����ȣ���ȴ����������ϡ���ᣬ�ټ�����������Һ
��������
Ũ������廯�Ʒ�Ӧ�����廯�⣬Ȼ�������廯����Ҵ���Ӧ�Ʊ������飬��Ũ�������ǿ�����ԣ����ܽ��廯�����������嵥�ʣ�ʹ��Һ�ʳ�ɫ��Ȼ��������ˮ��ȴ�����ռ������飻�������ܹ�������������Һ����ȡ����Ӧ�����Ҵ����廯�ƣ��廯���ܹ�����������Һ��Ӧ���ɵ���ɫ������
��1���廯����Ũ�����ڼ��������·�Ӧ�����廯�⣬�䷴Ӧ����ʽΪ��NaBr+H2SO4![]() NaHSO4+HBr���廯�����Ҵ�����ȡ����Ӧ���������飬�䷴Ӧ����ʽΪ��C2H5OH+HBr
NaHSO4+HBr���廯�����Ҵ�����ȡ����Ӧ���������飬�䷴Ӧ����ʽΪ��C2H5OH+HBr![]() C2H5Br+H2O��
C2H5Br+H2O��
��2���廯�Ƽ�������ˮ����Ӧ�м���������ˮ�����ܽ�NaBr���廯�⼫������ˮ����Ũ�������ǿ�����ԣ�����NaBr����������ԭ��Ӧ��Ϊ���ٸ���Ӧ���������ȼ�ˮϡ�ͣ���������Ũ�ȣ��ɼ����廯����������ʴ�Ϊ��C��
��3��������ķе���38.4�������ƺ��£�38.4��������ˮԡ���ȣ�ˮ����������¶Ȳ�����100����Ϊ�˱�֤�����������ȺͿ��ƺ��£�һ�����ˮԡ���ȣ�
��4����ȡ�߷�Ӧ������IJ�����������ʱ�������������������Ũ�ȣ��ɴ�ʹƽ�������ƶ�����������Ҵ���ת���ʣ�
��5��������Ϊ�л���ܶȱ�ˮ����������ˮ���������������ˮ���ռ����ռ��ʹ�ˮ�з��룻
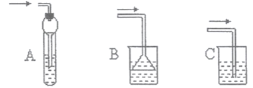
��6��A��HBr���弫������ˮ�����ڼ�������ˮ�����壬����װ���еĵ������������ӣ���������β��ֿռ���л������ã���ˮ���������ڣ��ձ���Һ���½����ڵ��ܿڣ�Һ�������䵽�ձ��У��ܷ�ֹ��������A���ϣ�
B��HBr���弫������ˮ�����ڼ�������ˮ�����壬����װ���еĵ�������©�����뵽Һ���У����ܷ�ֹ��������B�����ϣ�
C��HBr���弫������ˮ��������������ˮ�У�������������ˮ������װ����ѹǿ���罵�ͣ�������ѹѹ��Һ����룬������������C�����ϣ�
��ѡ��A��
��7���ֲ�Ʒ��ˮϴ�Ӻ��л����Գʺ���ɫ���������������ܽ���Br2��Ե�ʣ���������������Һϴ�ӳ�ȥ����������������Һ�������������ƣ���Ϊ�˷�ֹC2H5Br��ˮ�⣬���õ⻯����Һ������Ϊ�嵥����⻯�ط�Ӧ�����ɵⵥ�ʣ��ⵥ�����������ܻ��ܣ����ܴﵽ���ӵ�Ŀ�ģ��ʴ�Ϊ��B��
��8������������ԭ�Ӳ��������룬��ͨ��ȡ����Ӧ����ԭ��ȡ����Ȼ���������������飬�������Ϊ��ȡ�������������Թ��У�����������������ˮ��Һ�����ȣ���ȴ���ȼ���������ϡ���ᣬ�ټ�����������Һ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������γɶ����������Ѫ��[K4Fe(CN)6]����³ʿ����Ѫ���ص�
��1����֪��3K4Fe(CN)6]=2KCN + Fe3C + 3C + (CN)2�� +2N2��
��(CN)2��������������������Ŀ��Ϊn(��)�sn(��)=____��
��(CN)2��һ���������⻯���Եõ��Ҷ�����H2NCH2CH2NH2�����Ҷ���������ˮ������Ϊ�Ǽ��Է����⣬�����ܵ�ԭ����____��
��2����³ʿ���Ļ�ѧʽΪFe4[Fe(CN)6]3��д��������ӻ�̬��������Ų�ʽ____��
��3��Ѫ���أ���ͼ����Ѫ�쵰�ĺϳ�ԭ��֮һ��Ѫ��ɫ�е�Nԭ�ӵ��ӻ�����Ϊ____�����á�������ͼ�б��Fe2+����λ��_________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E���ֶ���������Ԫ�أ����ǵ�ԭ������������������B�ǵؿ��к�������Ԫ�ء���֪A��C��B��D�ֱ���ͬ����Ԫ�أ���B��D��Ԫ��ԭ�Ӻ���������֮����A��C��Ԫ��ԭ�Ӻ���������֮�͵�2�����ڴ���ͬ���ڵ�C��D��E����Ԫ���У�E��ԭ�Ӱ뾶��С��ͨ������£�����Ԫ�صĵ��������������壬���ֹ��塣
��1��AΪ______����Ԫ�ط��ţ���ͬ����BΪ______��CΪ______��D��ԭ�ӽṹʾ��ͼΪ______��
��2���ԱȽ�D��E��Ԫ�ص�����������Ӧˮ���������ǿ����______![]() ______���ѧʽ����
______���ѧʽ����
��3��A��B���γ�ԭ�Ӹ�����Ϊ![]() �Ļ�����仯ѧʽΪ______��
�Ļ�����仯ѧʽΪ______��
��4����E�ĵ���ͨ��A��B��C����Ԫ����ɵĻ������ˮ��Һ�У���д���÷�Ӧ�Ļ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
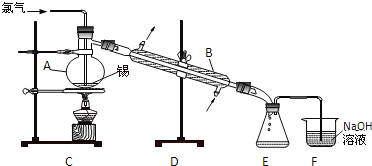
����Ŀ������SnCl2��SnCl4�����Ȼ��SnCl4����ɫҺ�壬����ˮ�⣬�۵㩁36�棬�е�114�棬���������۵�Ϊ231�森ʵ���������ڵĽ����������������ֱ��������ȡ��ˮSnCl4���˷�Ӧ���̷ų��������ȣ���ʵ������ȡ��ˮSnCl4��װ����ͼ��ʾ��
���������գ�
��1������A������__�� ����B������__��
��2��ʵ�����Ƶõ������к�HCl��ˮ�������뾻������ͨ��Һ̬���з�Ӧ����ȥHCl��ԭ�������__����ȥˮ��ԭ����__��
��3�������ۻ���ͨ��������ʼ��Ӧ������ֹͣ���ȣ���ԭ����__������Ӧ����ȥ����11.9g����Ӧ������ƿ���ռ���23.8g SnCl4����SnCl4�IJ���Ϊ__��
��4��SnCl4��ˮǿ��ˮ��IJ���֮һ�ǰ�ɫ�Ĺ�̬��������������SnCl4������¶�ڳ�ʪ�����У�Ԥ�ڿɿ�����������__��
��5����֪��ԭ��Sn2+��I����SnCl2Ҳ��ˮ���������ܵ�Sn��OH��Cl����μ����Ƶõ�SnCl4��Ʒ���Ƿ����������SnCl2��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̬�������������ϣ���150��ʱ1L�û������9L������ϣ����ȼ�պ�ָ���ԭ״̬�����������������10L�����и��������з��ϴ��������ǣ� ��
A.CH4 ��C2H4B.CH4 ��C3H6C.C2H2 ��C3H4D.C2H2 ��C2H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
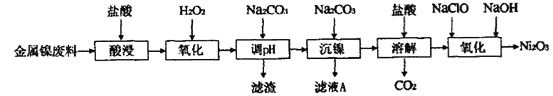
����Ŀ������������(Ni2O3)��һ�ֻҺ�ɫ����ζ�й���Ŀ�״������ϸ��ĩ��������������ܵ�ء���ҵ���Խ�������������Ni2O3�Ĺ����������£�
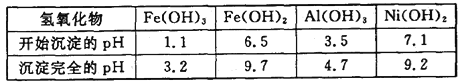
�±�Ϊ�������������������������pH(�迪ʼ����ʱ��������Ũ��Ϊ1.0 mol��L��1)��
�ش��������⣺
(1)Ϊ��߽��������Ͻ��������ʣ��ڡ������ʱ�ɲ�ȡ�Ĵ�ʩ��___________��(д���㼴��)
(2)������������Һ�к���Ni2����Fe2+��Fe3+��Al3+�ȡ���H2O2��������__________�������ӷ���ʽΪ______________________��
(3)�ڳ���ǰ�����Na2CO3������ҺpH�ķ�ΧΪ__________��
(4)���������ӷ���ʽΪ_____________________��
(5)��������Ni2O3�����ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ļ���������ܱ������з������·�Ӧ��xA(g)+yB(g)![]() zC(g)���ﵽƽ�����A�����Ũ��Ϊ0.5 mol/L�������¶Ȳ��䣬���ܱ��������ݻ�ѹ��Ϊԭ����һ���ٴδﵽƽ����AŨ��Ϊ0.75 mol/L��������������ȷ����
zC(g)���ﵽƽ�����A�����Ũ��Ϊ0.5 mol/L�������¶Ȳ��䣬���ܱ��������ݻ�ѹ��Ϊԭ����һ���ٴδﵽƽ����AŨ��Ϊ0.75 mol/L��������������ȷ����
A.ƽ�����淴Ӧ�����ƶ�B.x+y<z
C.B�����ʵ���Ũ�ȼ�СD.C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2Υ���ŷŻ�������꣬�������·�������β���е�SO2��
����һ������̿��ԭ��
2C(s) +2SO2(g) S2(g)+2CO2(g) +Q(Q>0)
һ�������£�������Ũ����ʱ��Ĺ�ϵ��ͼ��
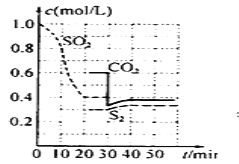
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��___����һ�δﵽƽ���ʱ���ǵ�___min��
��2��0-20min��ѧ��Ӧ���ʱ�ʾv(SO2)=___��
��3����60minʱ�¶����ߣ�CO2�����Ũ�Ƚ�___(���������������С������������)��
��4��30minʱƽ�ⷢ���ƶ���������___��
�������������������շ�
��5��Na2SO3��Һ����SO2�����ӷ���ʽΪ��___��
��6�������£���Na2SO3��ȫת��ΪNaHSO3ʱ����Һ���������Ũ�ȹ�ϵΪ��������>������=������<����
c(Na+)+c(H+)___c(SO32-)+c(HSO3-)+c(OH-)
c(Na+)___c(SO32-)+c(HSO3-)+c(H2SO3)
��7��NaHSO3��Һ�д���SO32-��ԭ��___��NaHSO3��Һ�д���H2SO3��ԭ��___��NaHSO3��Һ�����ԣ���������Ϸ�������ԭ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���![]() ֻ����
ֻ����![]() ��
��![]() ��
��![]() ����Ԫ�أ��������л��ϳɵ��м��塣
����Ԫ�أ��������л��ϳɵ��м��塣![]() ���л���������
���л���������![]() �г��ȼ������
�г��ȼ������![]()
![]() ��
��![]()
![]() ������ͼ��������Է�������Ϊ84��������������ͼ��֪
������ͼ��������Է�������Ϊ84��������������ͼ��֪![]() �����к���
�����к���![]() ����λ�ڶ˵㴦��
����λ�ڶ˵㴦��![]() �����˴Ź���������������壬�����֮��Ϊ
�����˴Ź���������������壬�����֮��Ϊ![]() ��
��
(1)![]() �ķ���ʽ��______��
�ķ���ʽ��______��
(2)![]() �Ľṹ��ʽ��______��
�Ľṹ��ʽ��______��
(3)���������У�һ������������![]() ������Ӧ����______������ţ���
������Ӧ����______������ţ���
A��![]() B��
B��![]()
C������![]() ��Һ D��
��Һ D��![]() ��
��![]() ��Һ
��Һ
(4)���![]() ��
��![]() ��ͬ���칹�壬
��ͬ���칹�壬![]()
![]() ������
������![]()
![]() ��ȫ�ӳɡ���֪
��ȫ�ӳɡ���֪![]() ������̼ԭ����ͬһ��ƽ���ϣ���û��˳���칹������
������̼ԭ����ͬһ��ƽ���ϣ���û��˳���칹������![]() �Ľṹ��ʽΪ______��
�Ľṹ��ʽΪ______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com