

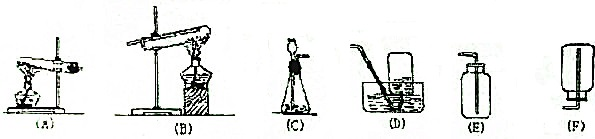
分析 用NH3、B2O3为原料制备BN晶体,根据装置图可知,Ⅰ装置中用氯化铵与氢氧化钙产生氨气,经Ⅱ装置干燥后,氨气在管式电炉中与B2O3反应,生成BN,所以装置Ⅱ应为干燥管中加入碱石灰,反应中有氨气要用酸吸收,所以Ⅳ装置是吸收氨气尾气的装置,为防止倒吸,气体应从b导管进入,据此答题.
解答 解:用NH3、B2O3为原料制备BN晶体,根据装置图可知,Ⅰ装置中用氯化铵与氢氧化钙产生氨气,经Ⅱ装置干燥后,氨气在管式电炉中与B2O3反应,生成BN,所以装置Ⅱ应为干燥管中加入碱石灰,反应中有氨气要用酸吸收,所以Ⅳ装置是吸收氨气尾气的装置,为防止倒吸,气体应从b导管进入,
(1)根据上面的分析可知,化合物X是氢氧化钙,装置Ⅱ中的药品和仪器是 碱石灰 和干燥管,
故答案为:氢氧化钙;碱石灰;干燥管;
(2)装置Ⅲ中氨气与B2O3反应,生成BN,根据元素守恒可知,反应的化学方程式是B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O,
故答案为:B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
(3)氨气易溶于水,装置Ⅳ中广口瓶里盛装的是水,其作用是吸收未反应的氨气,为防止倒吸,气体应从b导管进入,
故答案为:吸收未反应的氨气;b;
(4)为防止装置内空气中的O2对制备反应的不利影响,可以用氨气排尽装置中的空气,则检验装置内空气被排尽的方法是先加入药品,连接装置Ⅰ、Ⅱ、Ⅲ,加热Ⅰ,用湿润的红色石蕊试纸在装置末导管口检验,若变蓝色,则说明空气已排尽,
故答案为:加热Ⅰ,用湿润的红色石蕊试纸在装置末导管口检验,若变蓝色,则说明空气已排尽;
(5)设实际产生BN的质量为xg,根据方程式B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O△m(固体),
50 20
x 8.4-6.4
则$\frac{50}{x}=\frac{20}{8.4-6.4}$,所以x=5,
根据元素守恒,8.4g B2O3固体理论上产生氮化硼的质量为$\frac{8.4}{70}×50$g=6g,所以氮化硼的产率为$\frac{5}{6}$×100%=83.3%,
故答案为:83.3%;
(6)用NH3与BCl3在高温下反应制备氮化硼的同时会产生氯化氢,氯化氢对设备腐蚀,导致成本升高,
故答案为:用NH3与BCl3在高温下反应制备氮化硼的同时会产生氯化氢,氯化氢对设备腐蚀,导致成本升高.
点评 本题主要考查物质的制备、分离提纯,难度中等,注意元素守恒思想的应用和实验基本操作的应用,可以培养学生综合分析问题和解决问题的能力.


科目:高中化学 来源: 题型:选择题

| A. | N2(g)与O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 mol O原子结合生成O2(g)时需要吸收498 kJ能量 | |
| C. | 1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量 | |
| D. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444 kJ•molˉ1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属甲比金属乙活泼 | |
| B. | 原电池中电子从负极经过溶液流向正极 | |
| C. | 电解池中电解质溶液的阳离子向阴极迁移 | |
| D. | 在铁制品上镀银,铁做正极,银做负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率(10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-6 mol•L-1的溶液 | B. | pH<7的溶液 | ||
| C. | c(H+)>c(OH-)的溶液 | D. | 滴加酚酞显无色的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com