
某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式:
________________________________________________________________________,
________________________________________________________________________。
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入
________________________________________________________________________。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
③加入__________________________________________________________________,使沉淀完全溶解。
④_______________________________________________________________________,
得到纯净的硝酸钙晶体。
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
对于反应CO(g)+H2O(g) CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的
CO 2(g)+ H 2(g) △H﹤0,在其他条件不变的
情况下
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
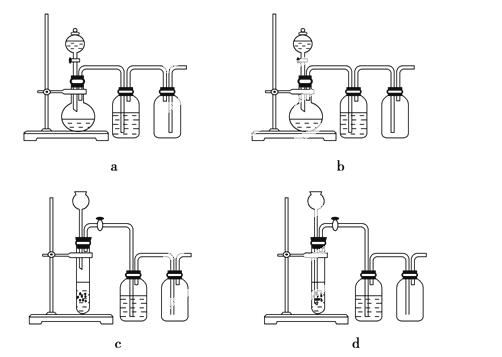
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g/L。某兴趣小组用题9图1装置(夹持装置略)收集某葡萄酒中SO2,并对含量碱性测定。
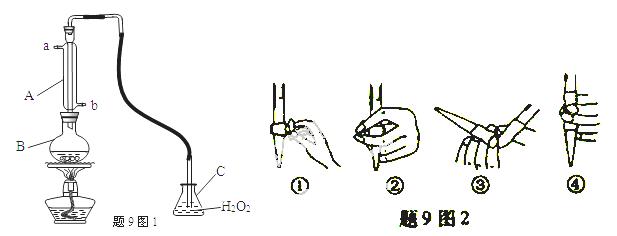
(1)仪器A的名称是_______,水通入A的进口为_________。
(2)B中加入300.00ml葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________。
(3)除去C中过量的H2O2,然后用0.0900mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择题9中图2中的_____;若滴定终点时溶液的pH=8.8,则选择的指示剂为__________;若用50ml滴定管进行实验,当滴定管中的液面在“10”处,则管内液体 的体积(填序号)____(①=10ml,②=40ml,③<10ml,④>40ml)
的体积(填序号)____(①=10ml,②=40ml,③<10ml,④>40ml)
(4)滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为:__g/L。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
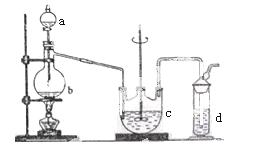
(1)b中反应的离子方程式为__________________,c中试剂为_______________ ______。
______。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室以含有Ca2+、Mg2+、Cl-、SO 、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
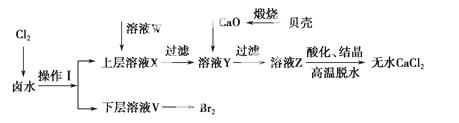
(1)操作Ⅰ使用的试剂是________,所用主要仪器的 名称是________。
名称是________。
(2)加入溶液W的目的是________。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是________。酸化溶液Z时,使用的试剂为________。
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1. |
(3)实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是________。
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3;将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于________。设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)。
____________________________。仪器自选。供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上研究燃料脱硫的过程中,涉及如下反应:
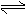 CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g),K1,△H1= 218.4 kJ·mol-l(反应I)

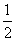 CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g) 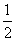 CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
CaS(s)+2CO2(g),K2,△H2= -87.8 kJ·mol-l(反应II)
 (1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(1)反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)的△H= ;平衡常数K= (用K1,K2表示)。
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:

前100 s 内v(SO2)= mo1·L-1·s-l,平衡时CO的转化率为 。
(3)若只研究反应II,在不同条件下其反应能量变化如下图所示:图中曲线a到曲线b的措施是________,恒温恒容时,下列说法能说明反应Ⅱ到达平衡状态的是____ 。

A.体系中气体的平均摩尔质量不再改变
B.v(CO)=v(CO2)
C.CO的转化率达到了最大限度
D.体系内气体压强不再发生变化
(4)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量[用n(CO)表示]对CaO(s)+3CO(g)+SO2(g)
 CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
CaS(s)+3CO2(g)反应的影响,实验结果如右图所示(图中T表示温度):
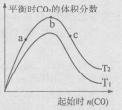
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是____ 。
②图像中T2 T1(填“高于”、“低于”、“等于”或“无法确定”):判断的理由是____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+ H2(g) HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是
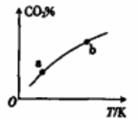
A. 正反应速率
B. 逆反应速率
C. HCOOH(g)的浓度
D. H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是( )
A. 盐类都能水解
B. 配制FeCl3溶液,为了抑制水解,常加入盐酸
C. 盐类的水解反应,通常是吸热反应
D. 盐类水解是指组成盐的离子跟水电离出来的H+或OH—生成弱电解质的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com