

分析 假设金属元素的元素符号是M,因为金属元素的化合价是+1,碳酸氢根的化合价是-1,碳酸根的化合价是-2,因此该金属元素的碳酸氢盐和碳酸盐的化学式可以表示为MHCO3和M2CO3,与稀盐酸反应的化学方程式分别是MHCO3+HCl═MCl+H2O+CO2↑、M2CO3+HCl═MHCO3+MCl,
(1)根据碳元素守恒及生成二氧化碳的量计算出混合物中含碳量;
(2)计算出混合物的平均摩尔质量,然后判断碱金属名称,从而可确定两种碳酸盐的化学式;
(3)根据两种碳酸盐的质量、物质的量列式计算出消耗氯化氢的物质的量,再根据c=$\frac{n}{V}$计算出滴加的盐酸的浓度.
解答 解:(1)根据质量守恒可知:n(C)=n(CO2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,
6.14 g 混合物中含有的碳元素的质量为:n(C)=0.005mol×12g/mol×10=0.6g,
则混合物中碳元素的质量分数为:w(C)=$\frac{0.6g}{6.14g}$×100%=9.77%,
答:混合物中碳元素的质量分数为9.77%;
(2)混合物的平均摩尔质量M=$\frac{6.14g}{0.005mol×10}$=122.8g/mol,
若M(M2CO3)=122.8 g/mol,则M(M)=31.4g/mol,
若M(MHCO3)=122.8 g/mol,则M(M)=61.8g/mol,
即:31.4g/mol<M(K)<61.8g/mol,
所以碱金属元素是钾元素,两种碳酸盐的化学式:K2CO3、KHCO3,
答:这两种碳酸盐的化学式分别为K2CO3、KHCO3;
(3)碳酸盐的总物质的量为:n(K2CO3)+n(KHCO3)=0.05 mol,
质量为:n(K2CO3)×138 g/mol+n(KHCO3)×100 g/mol=6.14 g,
解得:n(K2CO3)=0.03mol、n(KHCO3)=0.02 mol,
则:n(K2CO3)~n(CO2)~2n(HCl) n(KHCO3)~n(CO2)~n(HCl)
0.03 mol 0.03mol 0.06 mol 0.02 mol 0.02 mol 0.02 mol
所以消耗盐酸的总物质的量为:n(HCl)=0.06 mo+0.02mol=0.08 mol,
则所滴加盐酸的物质的量浓度为:c(HCl)=$\frac{0.08mol}{0.32L}$=0.25mol/L,
答:所滴加盐酸的物质的量浓度为0.25mol/L.
点评 本题考查了混合物反应的计算,题目难度较大,明确发生反应的实质为解答关键,注意掌握守恒法、极值法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4═H${\;}_{2}^{+}$+SO${\;}_{4}^{2-}$ | B. | Fe2(SO4)3═2Fe2++3SO${\;}_{4}^{2-}$ | ||
| C. | Ba(OH)2═Ba2++2OH- | D. | K2CO3═2K++CO3-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 3:4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 越活泼的金属越难冶炼 | |
| B. | 合金的性质与其成分金属的性质不完全相同 | |
| C. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 | |
| D. | 工业上金属Mg、Al都是用电解其熔融的氯化物制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 磁性氧化铁与浓盐酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| C. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3H+=Fe3++3H2O | |
| D. | 溴化亚铁溶液与足量氯水反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的物质的量浓度为1mol•L-1 | |
| B. | 该溶液中含有29.25gNaCl | |
| C. | 配制100 mL该溶液需称量5.85gNaCl | |
| D. | 量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
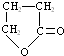 ,化合物C的结构简式是HOCH2CH=CHCOONa.
,化合物C的结构简式是HOCH2CH=CHCOONa. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L H2SO4溶液中含98g H2SO4 | B. | 0.1 L含24.5g H2SO4的溶液 | ||
| C. | 0.5 L水中溶有49g H2SO4 | D. | 98g H2SO4溶于水配成2 L溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com