
 .
. 分析 (1)1mol氯化钙完全电离产生2mol钙离子,所以C(Cl-)=2C(CaCl2);
(2)依据n=$\frac{V}{Vm}$=cV计算解答;
(3)分析反应中元素化合价,所含元素化合价降低的反应物为氧化剂,对应产物为还原产物;
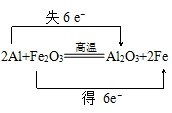
(4)2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3中,Fe元素的化合价降低,Al元素的化合价升高,结合氧化还原反应基本概念及电子守恒来解答.
解答 解:(1)1mol氯化钙完全电离产生2mol钙离子,所以C(Cl-)=2C(CaCl2),则0.5L 1mol/L的CaCl2溶液,Cl-的物质的量浓度为 2mol/L;
故答案为:2;
(2)标况下,33.6L的NH3溶解于水配成1L溶液,则溶液的物质的量浓度为:$\frac{\frac{33.6L}{22.4L/mol}}{1L}$=1.5mol/L;
故答案为:1.5;
(3)在Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,氧化铁中+3价的铁将为铁单质中0价,所以氧化剂是Fe2O3;还原产物:Fe;
故答案为:Fe2O3;Fe;
(4)在反应Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,化合价降低元素Fe所在的反应物Fe2O3是氧化剂,化合价升高元素Al所在的反应物是还原剂,化合价的升降数=转移电子数=6,所以反应中生成2mol Fe时,转移6mol电子,反应中生成1mol Fe时,转移3mol电子,电子转移情况如下: ,
,
故答案为: .
.
点评 本题考查物质的量浓度有关计算、氧化还原反应,为高考高频考点,把握以物质的量为核心计算公式,明确反应中元素的化合价变化为解答的关键,侧重物质的量浓度、氧化还原反应基本概念和转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 饱和氯水中:K+、Na+、Cl-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离水和四氯化碳的混合物时,四氯化碳从上口倒出 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| C. | 可以用酒精萃取碘水中的碘 | |
| D. | 海水通过蒸馏可制得淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 | |
| B. | SiO2是非金属氧化物,它不与任何酸反应 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ | |
| D. | 高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中滴入少量盐酸,然后滴入少量的氯化钡溶液 | 先无明显现象,后有白色沉淀. | 说明原溶液中含有SO42- |
| B | 向某氯化亚铁溶液中滴入少量氯水,然后滴入少量的KSCN溶液 | 溶液变成血红色 | 说明原氯化亚铁已氧化变质 |
| C | 加热分解某盐X,将产生的气体通入硝酸酸化的BaCl2溶液 | 实验开始立即产生白色沉淀 | X可能是NaHCO3 |
| D | 向溶液X中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和铝 | B. | 硅和钠 | C. | 硼和氮 | D. | 氯和碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com