
【题目】如图为N2(g)和 O2(g)反应生成 NO(g)过程中的能量变化,下列正确的是( )
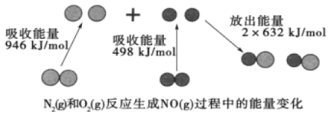
A.1molN2(g) 和 NA 个 O2(g) 反 应 放 出 的 能 量 为 180 kJ
B.1molN2(g)和 1molO2(g)具有总键能小于 2molNO(g)具有的总键能
C.该反应的热化学方程式为:N2(g)+ O2(g)= 2NO(g)△H=+180 kJmol﹣1
D.吸热反应一定需要加热才能发生
【答案】C
【解析】
化学反应的焓变等于反应物的总键能减去生成物的总键能。
A.根据图中数据可求得△H=946 kJmol﹣1+498 kJmol﹣1-2×623 kJmol﹣1=+180 kJmol﹣1,为吸热反应,所以1molN2(g)和 NA 个O2(g),即1molN2(g)和 1mol O2(g) 反应吸收的能量为 180 kJ,A项错误;
B. 化学反应的焓变等于反应物的总键能减去生成物的总键能,该反应为吸热反应,所以1molN2(g)和 1mol O2(g)大于2mol NO(g)的总键能,B项错误;
C.结合A分析,可推出该反应的热化学方程式为:N2(g)+ O2(g)= 2NO(g) △H=+180 kJmol﹣1,C项正确;
D. 吸热反应不一定需要加热才能发生,比如氢氧化钡晶体和氯化铵晶体的反应,D项错误;
答案选C。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求回答下列问题:
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H1
NH2COONH4(s)△H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol
①反应Ⅰ的△H1=__。
②一定温度下,在体积固定的密闭容器中按n(NH3):n(CO2)=2:1进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是__(填序号)。
A.容器内气体总压强不再变化
B.NH3与CO2的转化率相等
C.容器内混合气体的密度不再变化
(2)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
①该反应的化学平衡常数表达式为K=__。
②该反应为__(填“吸热”或“放热”)反应。
③某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为__℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,此时反应向__(填“正向”或“逆向”)进行。
(3)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO![]() (aq)
(aq)![]() PbCO3(s)+SO
PbCO3(s)+SO![]() ( aq)。
( aq)。
已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K=__。
Ⅱ.N2H4—O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
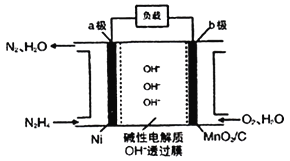
(1)N2H4的电子式为__;
(2)a极的电极反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是

A. BOH属于弱碱
B. BOH的电离常数K=1×10-4.8
C. P点所示的溶液中:c(Cl-)>c(B+)
D. N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯可用于制备二茂铁(Fe(C5H5)2,结构简式为 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法错误的是( )
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。下列说法错误的是( )


A.制备二茂铁总反应为:Fe+2![]() =
=![]() +H2↑
+H2↑
B.电解制备需要在无水条件下进行
C.Ni电极与电源负极连接
D.阳极电极反应为:2Br--2e-=Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
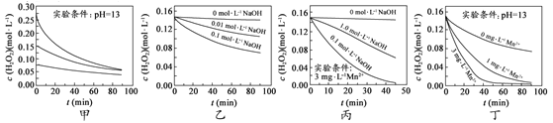
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 2L 0.5mol/L亚硫酸溶液中含有的H+离子数为2NA
B. 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
D. 某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目小于0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇能发生如下反应:
①CH3CH2OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
②2Cu+O2![]() 2CuO,CH3CH2OH+CuO
2CuO,CH3CH2OH+CuO![]() CH3CHO+H2O+Cu。
CH3CHO+H2O+Cu。
由以上反应得出的结论错误的是( )
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键、碳氧键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com