
【题目】以冶铝的废弃物铝灰为原料制取超细α﹣氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为(填选项编号).
(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 .
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 .
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3 , 已知:25℃时,Ksp[Fe(OH)3]=4.0×10﹣38 , 则该温度下反应Fe3++3H2OFe(OH)3+3H+的平衡常数为 .
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)212H2O] ![]() 2Al2O3+2NH3↑+N2↑+
2Al2O3+2NH3↑+N2↑+
5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置.
①集气瓶中收集到的气体是 (填化学式).
②KMnO4溶液褪色,发生的离子反应方程式为
【答案】
(1)Al2O3+3H2SO4=Al2(SO4)3+3H2O
(2)B
(3)2Fe2++H2O2+2H+=2Fe3++2H2O
(4)静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有
(5)2.5×10﹣5
(6)N2;2MnO4﹣+5SO2+2H2O=2Mn2++5SO42﹣+4H+
【解析】解:铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+ , 加双氧水,Fe2+被氧化为Fe3+ , 加入K4[Fe(CN)6]Fe3+转化为沉淀,过滤,在滤液中加入硫酸铵,生成NH4Al(SO4)2 , 结晶、干燥、煅烧得到α﹣Al2O3;(1)氧化铝属于两性氧化物,能溶于强酸和强碱溶液,氧化铝和稀硫酸反应生成硫酸铝和水,反应方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O,
所以答案是:Al2O3+3H2SO4=Al2(SO4)3+3H2O;
(2.)能够焙烧固体的装置是坩埚,NaOH能和二氧化硅反应生成硅酸钠,所以不能采用瓷坩埚灼烧,所以应该采用铁坩埚,故选B;
(3.)在实验流程中,H2O2具有氧化性,能氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,所以答案是:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4.)铁离子和铁氰化钾反应产生沉淀,其检验方法是:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有,
所以答案是:静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有;
(5.)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH﹣)=4.0×10﹣38 , c(H+)= ![]() ,反应Fe3++3H2OFe(OH)3+3H+的平衡常数K=
,反应Fe3++3H2OFe(OH)3+3H+的平衡常数K= ![]() =
= ![]() =2.5×10﹣5 ,
=2.5×10﹣5 ,
所以答案是:2.5×10﹣5;
(6.)①煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)212H2O]═2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,混合气体通入饱和的亚硫酸氢钠溶液中,氨气和三氧化硫溶解,剩余气体通入高锰酸钾溶液,二氧化硫被氧化生成硫酸根离子,剩余的气体N2 采用排水法收集,
所以答案是:N2;
②二氧化硫被酸性高锰酸钾溶液氧化而导致KMnO4溶液褪色,二者发生氧化还原反应生成锰离子、硫酸根离子和氢离子,离子方程式为2MnO4﹣+5SO2+2H2O=2Mn2++5SO42﹣+4H+ ,
所以答案是:2MnO4﹣+5SO2+2H2O=2Mn2++5SO42﹣+4H+ .


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示),下列说法错误的是( )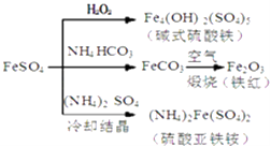
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2比FeSO4易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于NH3和CO2的说法中正确的是( )
A.都是直线形结构
B.中心原子都采取sp杂化
C.NH3为三角锥形结构,CO2为直线形结构
D.N原子和C原子上都没有孤对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:实验室可供选择的用于去除气体杂质的试剂有:浓硫酸、无水氯化钙、五氧化二磷、碱石灰(主要成分为NaOH和CaO)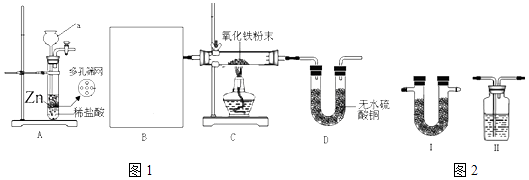
①实验室用如图1所示装置进行纯净干燥的氢气还原氧化铁实验.a装置名称为 , 方框B内应选用如图2装置(填“Ⅰ”或“Ⅱ”),选用的除杂试剂为(填试剂名称).
②实验室常用36.5%浓盐酸(ρ=1.2gcm﹣3)配制稀盐酸,若要配制500mL,0.5molL﹣1稀盐酸,需用量筒取用浓盐酸mL.
③写出装置C中发生反应的化学方程式并用单线桥标明电子的转移 . 实验结束时应该采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中所含分子物质的量最多的是( )
A. 56 g N2 B. 标准状况下3.36 L O2
C. 6 g H2 D. 3.01×1023个H2SO4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL0.3molL﹣1Na2SO4溶液和50mL0.2molL﹣1Al2(SO4)3溶液混合后,溶液中SO42﹣离子的物质的量浓度(设体积为二者之和)为( )
A.0.2molL﹣1
B.0.25 molL﹣1
C.0.4 molL﹣1
D.0.5 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室对下列药品的保存方法错误的是( )
A.少量碳酸钙固体放在广口瓶中
B.少量浓硝酸放在棕色细口瓶中
C.少量金属钠保存在煤油中
D.少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com