
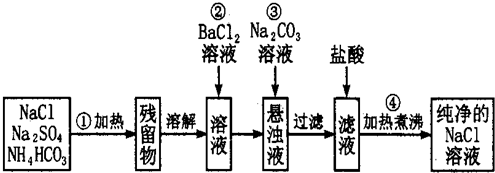
分析 碳酸氢铵不稳定,加热分解生成二氧化碳、氨气和水,加热后残留物为氯化钠和硫酸钠,将残留物溶解后加入氯化钡可生成硫酸钡沉淀,过滤后得到滤液含有氯化钠、氯化钡,加入碳酸钠溶液生成碳酸钡沉淀,过滤,滤液中含有碳酸钠和氯化钠,加入盐酸,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,加热煮沸,可得到纯净的氯化钠溶液,以此解答该题.
解答 解:碳酸氢铵不稳定,加热分解生成二氧化碳、氨气和水,加热后残留物为氯化钠和硫酸钠,将残留物溶解后加入氯化钡可生成硫酸钡沉淀,过滤后得到滤液含有氯化钠、氯化钡,加入碳酸钠溶液生成碳酸钡沉淀,过滤,滤液中含有碳酸钠和氯化钠,加入盐酸,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,加热煮沸,可得到纯净的氯化钠溶液,
(1)根据图示,操作①是将固体混合物加热,使用到的仪器是坩埚,故答案为:坩埚;
(2)加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠等新的杂质,
故答案为:否; 改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,以后操作中无法除去;
(3)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,
故答案为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽(或其他的方法);
(4)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤,故答案为:除去过量的Ba2+;
(5)操作④加热煮沸溶液的目的是除去滤液中溶解的CO2和多余的盐酸,故答案为:除去滤液中溶解的CO2和多余的盐酸.
点评 本题考查了物质分离、提纯方法的综合应用,题目难度中等,注意掌握化学实验基本操作方法,明确在除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,把握好此原则需要有扎实的基础知识和缜密的思维.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该有机物分子中碳、氢、氧原子个数比为1:2:3 | |
| B. | 该有机物分子中碳、氢原子个数比为1:2 | |
| C. | 该有机物中必含氧元素 | |
| D. | 该有机物中可能不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2$\stackrel{空气中灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
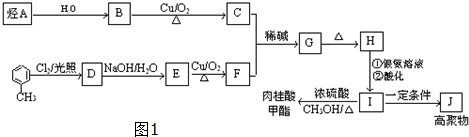
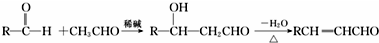
 $→_{△}^{硫酸}$
$→_{△}^{硫酸}$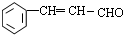 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固定都能发生分解 | |
| B. | 不可用元素周期律解释热稳定性:Na2CO3>NaHCO3 | |
| C. | 分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠,则两种物质均受热分解 | |
| D. | 1L0.1mol•L-1NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com