

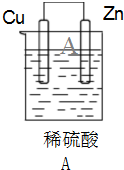
 ,
, ;
;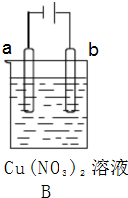 ,故答案为:
,故答案为: ;
;
| ||
| ||


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、降低温度 |
| B、加入少量MnO2 |
| C、加入少量FeCl3 |
| D、增大H2O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2完全转化为SO3 |
| B、各物质浓度均不再改变 |
| C、SO2和SO3的浓度一定相等 |
| D、正、逆反应速率相等且等于零 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的化合物称为二肽,二肽还可以继续与其它的α-氨基酸分子脱水形成三肽、四肽以致生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成二肽的种类有( )
的化合物称为二肽,二肽还可以继续与其它的α-氨基酸分子脱水形成三肽、四肽以致生成长链的多肽.若丙氨酸[CH3CH(NH2)COOH]与甘氨酸[H2N-CH2-COOH]的混合物在一定条件下反应,可形成二肽的种类有( )| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某中学学习小组在实验室帮助老师整理化学试剂时,发现一个盛有白色固体的试剂瓶标签破损(如图),请你根据已掌握的知识,参照猜想提示 I、II的形式,对该药品可能是什么物质作出猜想 (写出常见的两种 ),并设计实验验证方案、叙述现象.
某中学学习小组在实验室帮助老师整理化学试剂时,发现一个盛有白色固体的试剂瓶标签破损(如图),请你根据已掌握的知识,参照猜想提示 I、II的形式,对该药品可能是什么物质作出猜想 (写出常见的两种 ),并设计实验验证方案、叙述现象. 查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:
如图为某市售盐酸试剂瓶标签上的部分数据.通过计算回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com