
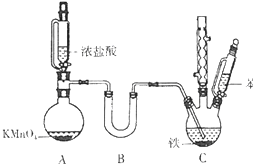
 氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):
氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):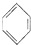 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$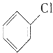 +HCl
+HCl| 沸点(℃) | 密度(g•mL-1) | 溶解性 | |
| 苯 | 80.1 | 0.88 | 难溶于水 |
| 氯苯 | 132.2 | 1.10 | 难溶于水,易溶于有机溶剂 |
| 对二氯苯 | 173.4 | 1.46 | 难溶于水,易溶于有机溶剂 |
| 邻二氯苯 | 180.4 | 1.30 | 难溶于水,易溶于有机溶剂 |
分析 (1)用浓盐酸和KMnO4反应制备氯气,Mn元素的化合价降低,Cl元素的化合价升高,根据得失电子守恒和电荷守恒书写离子反应方程式;
(2)干燥氯气需选择酸性干燥剂,因存放干燥剂的装置为U形管,需选择固体干燥剂;把氯气干燥后通入装有39mL苯的反应器C中(内有铁屑作催化剂),维持反应温度在40~60℃,反应的温度条件低于100℃,可用水浴的方法进行加热;
(3)装置C为球形冷凝管,起冷凝回流作用,防止液体挥发,A装置能够平衡压强,使液体顺利流下;
(4)氯苯中含有溶解的氯气、氯化氢、以及起催化作用产生的氯化铁,以上物质都可以与氢氧化钠反应,检验产品洗涤干净的方法为取最后一次洗涤液于试管中,通过检验氯离子的存在,判断是否洗净;
(5)冷凝管上端开口,逸出的HCl、Cl2污染空气,需用碱液吸收;
(6)根据苯的质量计算氯苯的理论产量,产量=(实际产量÷理论产量)×100%.
解答 解:(1)用浓盐酸和KMnO4反应制备氯气,MnO4-→Mn2+,Mn元素的化合价降低(+7→+2),2Cl-→Cl2,Cl元素的化合价升高(-1→0),最小公倍数为10,根据得失电子守恒和电荷守恒所以离子方程式为:2MnO4-+16H++10Cl-=2Mn2+↑+5C12↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2+↑+5C12↑+8H2O;
(2)B装置中盛放的药品为干燥氯气的试剂,因氯气为酸性气体,且存放干燥剂的装置为U形管,需选择固体干燥剂,可选择CaCl2或P2O5,把氯气干燥后通入装有39mL苯的反应器C中(内有铁屑作催化剂),维持反应温度在40~60℃,反应的温度条件低于水的沸点100℃,水浴加热能有效控制反应温度,且能保证受热装置受热均匀,所以可用水浴的方法进行加热,
故答案为:CaCl2或P2O5;40℃-60℃的水浴加热;
(3)装置C为球形冷凝管,苯与浓硝酸都以挥发,C起冷凝回流作用,提高原料利用率,A装置橡皮管起气压平衡管的作用,使漏斗里面的气压与烧瓶的始终相等,使液体顺利流下,
故答案为:防止液体挥发,能够平衡压强,使液体顺利流下;
(4)氯苯中含有溶解的氯气、氯化氢、以及起催化作用产生的氯化铁杂质,用氢氧化钠溶液洗涤,氯化氢和氢氧化钠发生中和反应,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,再用蒸馏水洗涤,分离出的产物干燥,检验产品洗涤干净的方法为取最后一次洗涤液于试管中,通过检验氯离子的存在,操作为:取最后一次洗涤液于试管中,加入硝酸银,若不出现沉淀,则证明已经洗干净,
故答案为:取最后一次洗涤液于试管中,加入硝酸银,若不出现沉淀,则证明已经洗干净;
(5)冷凝管上端开口,逸出的HCl、Cl2污染空气,存在一定缺陷,改进措施用碱液吸收,具体改进措施为:将冷凝管上端逸出的HCl、Cl2通入NaOH溶液中,防止污染空气,
故答案为:将冷凝管上端逸出的HCl、Cl2通入NaOH溶液中,防止污染空气;
(6)苯的质量为39mL×0.88g•mL-1=34.32g,完全反应生成氯苯的理论产量为34.32g×$\frac{112.5}{78}$=49.5g,故氯苯的产率为:$\frac{实际产量}{理论产量}$=$\frac{22g}{49.5g}$×100%≈44.4%,
故答案为:44.4%.
点评 本题考查有机物制备实验方案,题目难度中等,涉及对装置、操作与原理的分析评价等知识,明确实验目的、实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=2的溶液中:K+、Mg2+、I-、S2- | |
| B. | Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.
SOCl2是一种重要的化学试剂,常用作有机合成的氯化剂;利用SOCl2与水剧烈反应的性质,常用于金属水合氯化物的脱水剂;SOCl2还可作电池的正极材料.| SO3 | SCl2 | SOCl2 | SO2 | |
| 熔点 | 16.8℃ | -122℃ | -104.5℃ | -75.5℃ |
| 沸点 | 44.8℃ | 59℃ | 76℃ | -10℃ |
| 颜色 | 无色 | 樱桃红色 | 无色 | 无色 |
| 备注 | 不稳定 | 不稳定,沸点以上分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
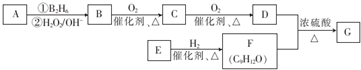
 ;该反应的反应类型为酯化反应或取代反应
;该反应的反应类型为酯化反应或取代反应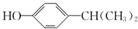
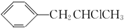 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):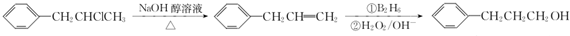 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X的简单气态氢化物的热稳定性比W的强 | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | 元素Y、Z的单质都有金属光泽 | |
| D. | X分别与Y、Z、W形成的化合物所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
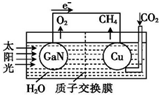 最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )
最近,科学家用氮化镓材料与铜组装如图所示的人工光合系统,实现了以CO2和H2O为原料制备CH4和O2.下列有关说法中正确的是( )| A. | 该装置只有化学能转化为电能 | |
| B. | 氮化镓电极是阴极 | |
| C. | 导线中经过2mol的电子,氮化镓电极生成1molO2 | |
| D. | 铜电极表面的电极反应式:CO2+8e-+8H+=CH4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
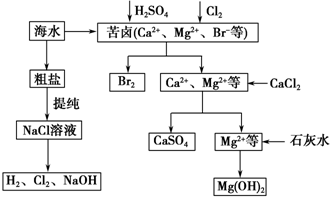
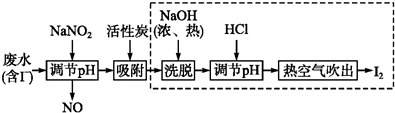
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com