
| A. | 元素分析 | B. | 红外光谱 | C. | 质谱 | D. | 核磁共振氢谱 |
分析 质谱仪其实是把有机物打成很多小块(有规律的,按照各官能团打开,所以一般有点经验的也能从小数字看出这种物质大概含有哪些官能团),会有很多不同的分子量出现,其中最大的那个就是该有机物的分子量,以此解答该题.
解答 解:A.元素分析仪来确定有机化合物中的元素组成,故A错误;
B.红外光谱是用于鉴定有机物中所含的各种官能团的,双键,三键,羟基,羧基羰基等等,故B错误;
C.质谱仪其实是把有机物打成很多小块,会有很多不同的分子量出现,其中最大的那个就是该有机物的分子量,故C正确;
D.核磁共振仪能测出有机物中氢原子子的种类以及数目之比,故D错误.
故选C.
点评 本题考查了常见确定有机物分子组成的方法,题目难度不大,明确核磁共振氢谱、红外光谱、质谱仪、紫外光谱等的含义为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| 待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
| 滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
| 滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
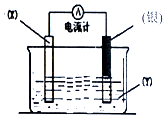 根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:
根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
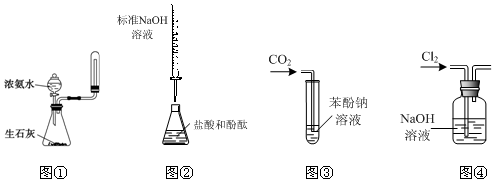
| A. | 实验室利用图①装置制取并收集氨气 | |
| B. | 利用图②装置测定盐酸的浓度 | |
| C. | 利用装置③验证碳酸的酸性强于苯酚 | |
| D. | 利用图④装置除去Cl2中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和0.10 mol H2O,达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO和H2O转化率增大 | |
| D. | 温度升高至800℃,达到新平衡时n(CO2)=0.34 mol,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-5 | B. | 0.001mol/L | C. | 1.8×10-7 | D. | 0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 和新制氢氧化铜悬浊液(NaOH碱性环境)反应的化学方程式
和新制氢氧化铜悬浊液(NaOH碱性环境)反应的化学方程式 +4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOC-COONa+2Cu2O↓+6H2O.
+4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOC-COONa+2Cu2O↓+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com