
分析 (1)ROn-+6I-+6H+═R-+3I2+3H20中,由质量守恒可知,n=3,RO3-离子中化合价的代数和为-1,反应中R元素的化合价由+5价降低为-1价;
(2)根据盐以及碱的定义判断.
解答 解:(1)①ROn-+6I-+6H+═R-+3I2+3H20中,由质量守恒可知,n=3,RO3-离子中化合价的代数和为-1,则R元素的化合价为-1-(-2)×3=+5,故答案为:+5;3;
②由R元素的化合价变化可知,该反应中RO3-得到的电子数为5-(-1)=6,故答案为:6;
(2)NaHCO3可电离出金属阳离子和酸根离子,为盐类物质,Ba(OH)2可电离出金属阳离子和氢氧根离子,为碱,
故答案为:NaHCO3;Ba(OH)2.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,注意电子守恒、电荷守恒的应用,题目难度不大.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 用硫酸清洗锅炉中的水垢 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 烧碱、冰醋酸、四氯化碳均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
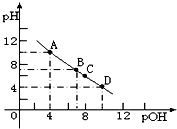 常温时,将氨气溶于水形成一浓度为0.1mol/L,pH为10的氨水溶液100mL.
常温时,将氨气溶于水形成一浓度为0.1mol/L,pH为10的氨水溶液100mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述两个反应都是氧化还原反应,且转移电子数相等 | |
| B. | Mn与Fe都属于ⅤⅡ族元素 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-2(△H1+△H2) | |
| D. | 根据两个反应可以看出,非自发反应加入合适的催化剂可以自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023就是阿伏加德罗常数 | |
| B. | 1 mol H2O中的氢原子数目为2NA | |
| C. | 阿伏加德罗常数个粒子的物质的量是1mol | |
| D. | 1mol NH3所含原子数约为2.408×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1=2Q2<Q3 | |
| B. | 容器Ⅰ中CO的百分含量比容器Ⅲ中CO的百分含量高 | |
| C. | 容器Ⅰ中反应的平衡常数比容器Ⅱ中反应的平衡常数小 | |
| D. | 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水高温条件下不易分解,是因为水分子内的H-O稳定 | |
| B. | 互为同分异构体的物质性质一定相似 | |
| C. | 分子组成若干个“CH12”原子团的有机化合物互称为同系物 | |
| D. | 因为互为同位素的核素的性质完全相同,所以这些核素在元素周期表中占据相同位置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
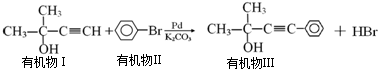

 则需要两种有机物的结构简式分别是HCHO和
则需要两种有机物的结构简式分别是HCHO和 或
或 和CH3MgBr
和CH3MgBr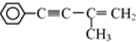 的反应方程式
的反应方程式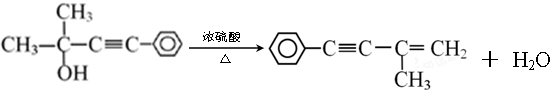
 CH3C≡CCH2OH+HI.
CH3C≡CCH2OH+HI.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.
;在此反应中,氧化剂是MnO2(填化学式,下同),氧化产物是Cl2,其中氧化性较强的是MnO2,盐酸在此反应中的作用是酸、还原剂;要制取标准状况下的氯气2.24升,理论上至少需要10mol/L的浓盐酸的体积为40ml.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com