
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气;
(2)氯气中混有水蒸气和HCl,可用浓硫酸干燥,用饱和食盐水除去氯化氢;
(3)根据二氧化锰和氯气的关系式计算生成氯气的体积;
(4)浓盐酸具有较强的还原性,可与二氧化锰发生氧化还原反应,但稀盐酸不反应.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,反应为MnO2+4HCl-$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl-$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸有挥发性,浓盐酸、水在加热时会产生气体,所以氯气中含有氯化氢、水蒸气;氯化氢极易溶于水,且饱和食盐水中含有氯离子,抑制氯气的溶解,所以饱和食盐水的作用是吸收氯化氢气体;浓硫酸有吸水性,所以其作用是除水蒸气,
故答案为:饱和食盐水;浓硫酸;
(3)设理论上可制得氯气的体积(标准状况)V1,
MnO2+4HCl-$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
87g 22.4L
8.7g V1
所以 V1=2.24 L
故答案为:22.4;
(4)10mol•L-1的浓盐酸40mL,n(HCl)=0.4mol,与足量的二氧化锰反应,因为浓盐酸和二氧化锰反应生成氯气,稀盐酸和二氧化锰不反应,所以随着反应的进行,浓盐酸变成稀盐酸,反应不再进行,故V2<V1,
故答案为:>.
点评 本题考查了氯气的实验室制法等知识点,侧重于学生的分析、计算能力的考查,难度不大,注意浓盐酸和二氧化锰能反应生成氯气,稀盐酸和二氧化锰不反应.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Ag+的浓度不再改变 | |
| B. | Ag+的生成速率和Ag+、Cl-结合生成AgCl的速率相等 | |
| C. | AgCl的质量不再减少 | |
| D. | Ag+与Cl-的物质的量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
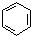
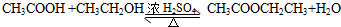 .
.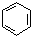 在浓硫酸作用下,与浓硝酸反应的化学方程式为
在浓硫酸作用下,与浓硝酸反应的化学方程式为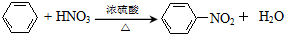 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
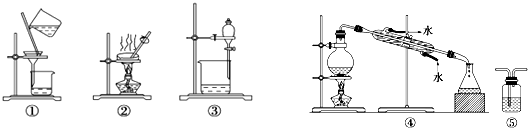
| A. | 用CCl4提取碘水中的碘,选③ | |
| B. | 用KMnO4溶液检验CH4是否含有C2H4,选⑤ | |
| C. | 粗盐提纯,选①和② | |
| D. | 石油的分馏,选④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下列给出了四种烃A、B、C、D的相关信息:
下列给出了四种烃A、B、C、D的相关信息: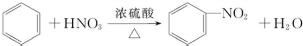 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象[ |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃时,将c mol•L-1的醋酸溶液与0.02mol•L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×{10}^{-9}}{c-0.02}$ | |
| B. | 0.1 mol•L-1醋酸溶液中:c(H+)2=c (H+)•c(CH3COO-)+KW | |
| C. | 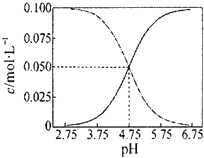 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
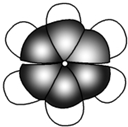
| A. | 苯不能使酸性KMnO4溶液褪色,属于饱和烃 | |
| B. | 常温下苯是一种易溶于水且密度比水小的液体 | |
| C. | 苯不具有典型的双键,故苯不能发生加成反应 | |
| D. | 苯分子为平面正六边形结构,6个碳原子之间的价键完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com