
【题目】已知:2FeCl3 +2KI =2FeCl2 +2KCl +I2,2FeCl2 +Cl2 =2FeCl3 ,2KMnO4 +16HCl =2KCl+2MnCl2 +5Cl2↑+ 8H2O。若某溶液中有Fe2+、I-和Cl-,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据下列金属的熔沸点:
金属 | Na | Cu | Al | Fe |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点(℃) | 883 | 2595 | 2200 | 3000 |
其中不能形成合金的是
A. Cu与Al B. Fe与Na C. Fe与Cu D . Al与Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)在下列化合物中:H2O 、Na2O 、I2 、NaCl、KOH、CO2、NH4Cl、Na2O2,请填空:
(1)只由非金属组成的离子化合物是________________,
(2)含有极性共价键的离子化合物是________________,
(3)只含有非极性共价键的是______________________,
(4)既有离子键又有非极性键的化合物是___________________。
(Ⅱ)有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。
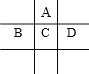
请回答下列问题:
(1)写出B元素的原子结构示意图_______________________;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为______________;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是:_______________,最后阶段反应的离子方程式为___________________;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,0.1 mol/L稀醋酸加水稀释,右图中的纵坐标y可以是( )

A.溶液的pH B.醋酸的电离平衡常数
C.溶液中醋酸的物质的量浓度 D.醋酸的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
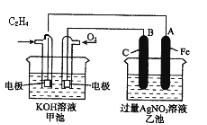
请根据该示意图完成下列题目:
(1)请问:甲池是________装置,乙池是________装置。
(2)在甲池中:通入C2H4的电极名称是___________,通入O2的电极的电极反应式是________。甲池中发生的反应的化学方程式为:________。
(3)在乙池中:B(石墨)电极的名称是________,A(Fe)电极的电极反应式为________。
(4)乙池中反应的化学方程式为________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2________mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国科学家将铅和氪两种元素的原子核对撞,获得了一种质子数为118,质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为( )
A.47
B.57
C.61
D.175
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A. 对2HI(g)![]() H2(g)+I2(g)平衡体系增加压强使颜色变深
H2(g)+I2(g)平衡体系增加压强使颜色变深
B. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动[
CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动[
C. 合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施
D. 在溴水中存在如下平衡:Br2(g)+H2O(l)![]() HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅]
HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷和其化合物在科研及生产中均有着重要的作用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为________。
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
I | 320 | 0.40 | 0.10 | 0.10 | t1 |
II | 320 | 0.80 | t2 | ||
III | 410 | 0.40 | 0.15 | 0.15 | t3 |
①平衡常数K:溶液II____溶液III(填“>”或“=”或“<”)
②反应达到平衡时,PCl3的转化率:容器II_____容器I(填“>”或“=”或“<”)
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:

阴极的电极反应式为_______;产品室中反应的离子方程式为__________。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于105mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= ______mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com