
【题目】以葡萄糖为燃料的微生物燃料电池的结构如图所示。下列关于该电池的叙述不正确的是( )
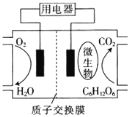
A.该装置属于原电池
B.放电过程中,H+从负极区向正极区迁移
C.在电池反应中,每消耗1 mol氧气,理论上能生成11.2 L(标准状况)CO2
D.电池负极的电极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
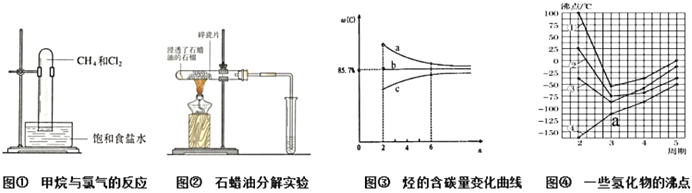
A. 图①:当CH4与Cl2体积比为1:2,维持足够长反应时间,CH4可全部变成CCl4
B. 图②:碎瓷片的作用与蒸馏实验中的碎瓷片作用不同
C. 图③:烷烃、烯烃、炔烃的单一物质及同类混合物含碳量随C原子数的变化曲线分别为a、b、c
D. 图④:点a代表的物质是PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写正确的是( )
A.苯酚钠溶液中通入少量二氧化碳:2![]() + CO2 + H2O
+ CO2 + H2O ![]() 2
2![]() + Na2CO3
+ Na2CO3
B.乙酸乙酯的制备:CH3COOH + CH3CH218OH![]() CH3COOCH2CH3 + H218O
CH3COOCH2CH3 + H218O
C.用铁作电极电解饱和氯化钠溶液:2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D.1-丙醇与钠反应:2CH3CH2CH2OH + 2Na → 2CH3CH2CH2ONa + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.二溴乙烷和水、溴苯和水、硝基苯和水三对物质都能用分液漏斗进行分离
B.苯与甲烷都不能使酸性高锰酸钾褪色,而甲苯能使酸性高锰酸钾褪色,则苯环使得甲基活化
C.甲苯与足量![]() 加成的产物的一氯代物有5种同分异构体
加成的产物的一氯代物有5种同分异构体
D.在溴乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银溶液,会有沉淀析出,则溴乙烷在碱性条件下能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:A的相对分子质量为_____。
(2)将9.0g A在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为_____。
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况)。用结构简式表示A中含有的官能团:_____________________。
(4)A的核磁共振氢谱如图。则A中含有_____种氢原子。

(5)综上所述,A的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )

A.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
B.该分子中的所有碳原子可能共平面
C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
D.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为3mol、7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2的应用和治理是当今社会的热点问题。CO工业上可用于高炉炼铁,发生如下反应:1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进 Fe2O3的转化,可采取的措施是____(选填序号)
a.用更高效的催化剂 b.粉碎矿石,增大接触面积
c.及时吸收或移出CO2 d.增大反应体系的压强
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)△H>0,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.再加入一些铁粉 b.充入一定量CO
c.增大压强 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁-次氯酸盐电池的工作原理如图,该电池反应为:
Mg+ClO-+H20=Mg(0H)2+Cl-。下列有关说法正确的是
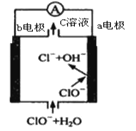
A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,C溶液中的溶质是MgCl2
C.负极反应式:ClO- +2e- +H20 = Cl- +20H-
D.b电极发生还原反应,每转移0.2mol电子,理论上生成0.1 mol Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为![]()
![]() ,请回答下列相关问题。
,请回答下列相关问题。
![]() 下表为部分键能数据,据此可算出
下表为部分键能数据,据此可算出![]() ___________
___________![]() 。
。
化学键 |
|
|
|
|
键能 | 332 | 611 | 414 | 436 |
![]() 一定温度下,向
一定温度下,向![]() 的密闭容器中充入
的密闭容器中充入![]() 发生脱氢反应,经过
发生脱氢反应,经过![]() 达到平衡状态,测得平衡时气体压强是开始的
达到平衡状态,测得平衡时气体压强是开始的![]() 倍。
倍。
![]() 内氢气的生成速率
内氢气的生成速率![]() _______,
_______,![]() 的平衡转化率为_______。
的平衡转化率为_______。
![]() 下列情况能说明该反应达到平衡状态的是____________
下列情况能说明该反应达到平衡状态的是____________![]() 填标号
填标号![]() 。
。
A.混合气体的平均相对分子质量保持不变 ![]() 与
与![]() 的物质的量之比保持不变
的物质的量之比保持不变
C.混合气体的密度保持不变 ![]() 的分解速率与
的分解速率与![]() 的消耗速率相等
的消耗速率相等
![]() 脱氢反应分别在压强为
脱氢反应分别在压强为![]() 和
和![]() 时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:

![]() 压强:
压强:![]() _________
_________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
![]() 若
若![]() ,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数
,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数![]() _______
_______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。
实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com