
【题目】已知:pOH=﹣lgc(OH﹣),298K时,向20.00 mL 0.10 molL﹣1氨水中滴入0.10 molL﹣1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示.下列说法正确的是( )

A.曲线PJN表示溶液中pH的变化
B.M点水的电离程度比J点大
C.M、P两点的数值之和a+b=14
D.pH与pOH交叉点J对应的V(盐酸)=20.00 mL
【答案】C
【解析】
pH越大,说明溶液碱性越强,pOH越大,说明溶液酸性越强;
A.根据图知,随着盐酸的加入,氨水溶液中pH减小、pOH增大,所以PJN为溶液中的pOH变化曲线,曲线MJQ表示溶液中pH变化曲线,故A错误;
B.M点pH比J点的pH大,说明J点溶液中NH4+的水解程度大,即M点水的电离程度比J点小,故B错误;
C.根据图知,PJN曲线表示pOH变化、MJQ曲线表示pH变化,M、P点为酸碱中和同一点,M点pH=a、P点pOH=b,则M点c(H+)=10-a mol/L、P点c(OH-)=10-bmol/L,相同温度下c(H+)c(OH-)=Kw,所以M、P两点的数值之和a+b=14,故C正确;
D.pH与pOH交叉点JpH=pOH,则c(H+)=c(OH-),为中性溶液,一水合氨是弱碱,要使混合溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20mL,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
Ⅰ.已知:氰化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8 + 2NaOH ![]() Na2S2O8 + 2NH3↑ + 2H2O
Na2S2O8 + 2NH3↑ + 2H2O
副反应:3Na2S2O8 + 2NH3 + 6NaOH![]() 6Na2SO4 + N2 + 6H2O
6Na2SO4 + N2 + 6H2O
某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
(实验一)实验室通过如图所示装置制备Na2S2O8。
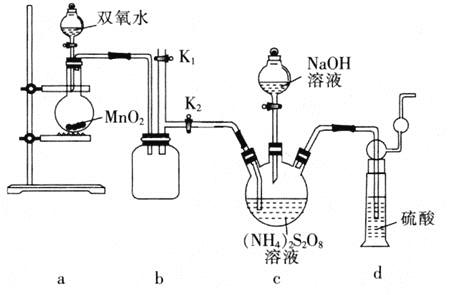
(3)装置b的作用是________。
(4)装置a中反应产生的气体需要持续通入装置c的原因是________。
(5)上述装置中还需补充的实验仪器或装置有________![]() 填字母
填字母![]() 。
。
A.温度计
B.洗气瓶
C.水浴装置
D.酒精灯
(实验二)测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mgL-1。
②Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先与CN-反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(6)滴定终点的现象是________。
(7)处理后的废水中氰化钠的浓度为_______ mgL-1;处理后的废水是否达到排放标准?_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时,其电离平衡曲线如下图所示:
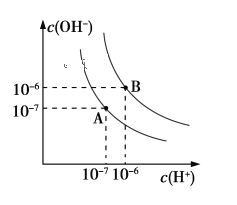
(1)则25 ℃时水的电离平衡曲线应为_______(填“A”或“B”),请说明理由_____________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,a+b=_______________
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5,则HA为_______(填“强”或“弱”)酸
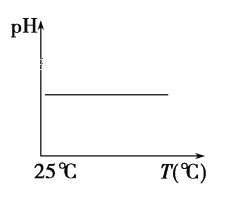
(5)下列溶液pH随温度的变化如图所示的是______(不考虑溶质、溶剂挥发)
a.稀硫酸 b.NaOH溶液 c.NaCl 溶液 d.氨水 e.醋酸
(6)下表室温下为几种弱电解质的电离平衡常数
CH3COOH | H2CO3 | H2S | NH3·H2O |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | 1.8×10-5 |
少量CO2与NaHS反应的离子方程式为_________________________________________。室温下,CH3COONH4溶液的pH_________7(填“>”、“<”或“=”)
(7)25 ℃时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,原因是___________________________________________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有![]() 、
、![]() 、Si
、Si![]() 、Br-、C
、Br-、C![]() 、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有![]() 、Na+
、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应
A.①②③④B.②③④
C.①③⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源。如图是甲醇的质子交换膜型燃料电池模型,下列有关说法正确的是( )
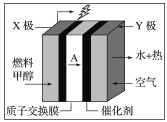
A.Y极为电池的负极
B.X极的电极反应式:CH3OH+H2O-6e-=CO2+6H+
C.若常温下用该电池电解100 mL KCl溶液至pH=12时,电池质子交换膜迁移的A为0.01 mol
D.空气以20%为氧气计算,X极每消耗1 mol甲醇,Y极必消耗168 L空气中的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ.某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g)![]() 2ClNO(g) △H1<0其平衡常数为K1
2ClNO(g) △H1<0其平衡常数为K1
ii. 2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=_____(用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=_____(用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:10min内υ(ClNO) =___________________,平衡常数K2=_________________;
II.除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是______________。
A.c(Na+) = c(HSO3-)+ 2c(SO32-)
B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
C.2c(Na+) =3c(H2SO3)+3c(HSO3-)+3c(SO32-)
D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
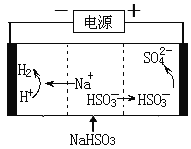
①工作一段时间后,阴极区溶液的pH______(填“增大”“减小”或“不变”);
②写出阳极的电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 ph=5时沉淀完全).其中分析错误的是
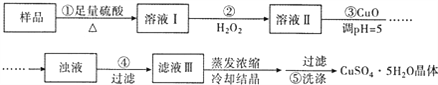
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
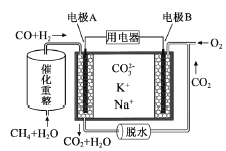
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时有三瓶溶液:
时有三瓶溶液:![]() 的盐酸、
的盐酸、![]() 的醋酸溶液和
的醋酸溶液和![]() 的氢氧化钠溶液,下列说法正确的是( )
的氢氧化钠溶液,下列说法正确的是( )
A.中和等体积![]() 的氢氧化钠溶液,所需
的氢氧化钠溶液,所需![]() 醋酸溶液的体积大于
醋酸溶液的体积大于![]() 盐酸的体积
盐酸的体积
B.等体积![]() 盐酸和
盐酸和![]() 醋酸溶液中分别加入少量相同的锌粒,盐酸中锌粒先反应完
醋酸溶液中分别加入少量相同的锌粒,盐酸中锌粒先反应完
C.当![]() 的醋酸溶液和
的醋酸溶液和![]() 的氢氧化钠溶液混合得到
的氢氧化钠溶液混合得到![]() 的溶液时,该溶液中
的溶液时,该溶液中![]() 大于
大于![]()
D.![]() 时
时![]() 的盐酸、
的盐酸、![]() 的醋酸溶液中水电离出的
的醋酸溶液中水电离出的![]() 均为
均为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com