
分析 (1)联胺被银离子氧化,银离子被还原生成单质银,-2价的N元素被氧化为N2;
(2)联胺被氧化失电子N2H4~N2失4e-,O2→O2-得到4e-,依据得失电子守恒计算;
(3)依据锅炉的质地以及反应产物性质解答.
解答 解:(1)联胺被银离子氧化,银离子被还原生成单质银,-2价的N元素被氧化为N2,反应方程式为:N2H4+4AgBr=4Ag↓+N2↑+4HBr,因此反应出现现象为:固体逐渐变黑,并有气泡产生,故答案为:固体逐渐变黑,并有气泡产生;
(2)联胺被氧化失电子N2H4~N2,O2→O2-得到4e-,联胺和氧气摩尔质量都是32g/mol,则等质量联胺和氧气物质的量相同,理论上1kg的联氨可除去水中溶解的O21kg,故答案为:1;
(3)由于肼的氧化产物是氮气,不会对锅炉造成腐蚀,而亚硫酸钠被氧化产物为硫酸钠,易生成硫酸盐沉淀影响锅炉的安全使用,与使用Na2SO3处理水中溶解的O2相比,联氨的优点是用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4,
故答案为:N2H4的用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4.
点评 本题考查了氮及其化合物性质,主要是氧化还原反应的计算及其产物的判断,题目难度中等.


科目:高中化学 来源: 题型:实验题
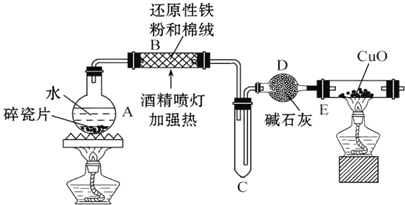 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
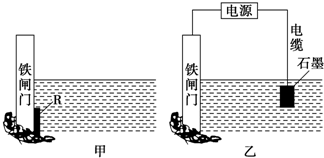 下面两个图都是金属防护的例子.
下面两个图都是金属防护的例子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol S(g) 与1mol O2(g)的总能量比1mol SO2(g)的总能量低Q kJ | |
| B. | 1mol S(g) 与1mol O2(g)反应生成1mol SO2(g)放出Q kJ 的能量 | |
| C. | S(s)+O2(g)═SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个 S(g) 与1个 O2(g)完全反应可放出 Q kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
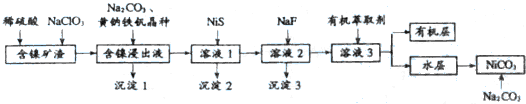
| 元素 | Na2+ | Fe3+ | Cu2+ | Ca2+ | Mg2+ | Zn2- |
| 浓度/g•L-1 | 5.25 | 0.47 | 0.30 | 0.40 | 0.18 | 0.81 |
| 开始沉淀PH | 6.4 | 2.2 | 4.7 | / | 9.6 | 6.5 |
| 完全沉淀PH | 8.4 | 3.5 | 6.7 | / | 11.6 | 8.5 |
| 难溶物 | NiS | CuS | ZnS | |
| 溶度积常数 | 1.07×10-21 | 1.27×10-26 | 2.93×10-25 | |
| 难溶物 | CaF2 | MgF2 | ZnF2 | NiF2 |
| 溶度积常数 | 1.46×10-10 | 7.42×10-11 | 3.04×10-2 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
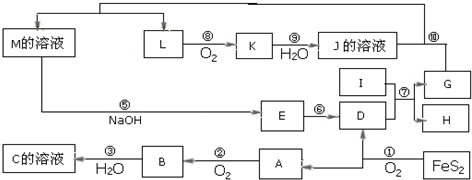
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两极附近颜色无明显变化 | B. | 两极产生等量气体 | ||
| C. | 阳极附近的颜色变红 | D. | 阴极附近的颜色变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com