
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 分子中共价键的键能越大,该物质的性质越不活泼 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 若把H2S写成H3S,违背了共价键的饱和性 |
分析 A.分子的稳定性与键的强弱有关;
B.物质的活泼性不仅与键能有关,还与分子中各个键的空间分布有关;
C.键长越短,键能越大;
D.S最外层有6个电子,只能结合2个H.
解答 解:A.分子的稳定性与键的强弱有关,与键的极性无关,单质非极性分子中键的极性为零,分子也很稳定,如氮气,故A错误;
B.物质的活泼性不仅与键能有关,还与分子中各个键的空间分布有关,分子活泼性是分子整体的性质,而一个分子并非只有一个化学键,故B错误;
C.一般分子中共价键的键能越大,键越越短,分子越稳定,故C错误;
D.S最外层有6个电子,只能结合2个H,形成H2S分子,若写成H3S分子,违背了共价键的饱和性,故D正确.
故选D.
点评 本题考查共价键的形成、物质稳定性的影响因素等,把握共价键的方向性和饱和性为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO${\;}_{3}^{2-}$ | B. | CH3COO- | C. | Fe2+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
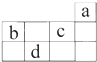
| A. | a原子的最外电子层上有8个电子 | |
| B. | c的最高价氧化物对应水化物为强酸 | |
| C. | d的原子半径比c的原子半径大 | |
| D. | b的气态氢化物比c的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431kJ•mol-1 | B. | 945.6kJ•mol-1 | C. | 649kJ•mol-1 | D. | 896kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
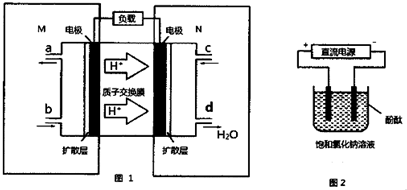
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水、酒精和水、苯酚和水 | |
| B. | 二溴乙烷和水、溴苯和水、硝基苯和水 | |
| C. | 甘油和水、乙醛和水、乙酸和乙醇 | |
| D. | 油酸和水、甲苯和水、己烷和苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com