
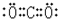 .
.
分析 (1)二氧化碳是碳原子和氧原子间通过共价双键形成的非极性分子;
(2)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式;
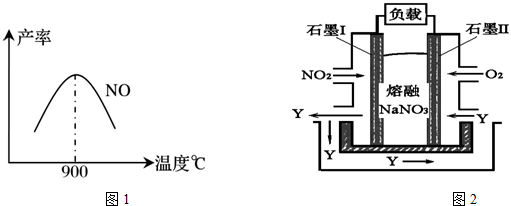
(3)145℃到900℃时,NO产率随温度升高而增大;对于放热反应,温度升高,则化学平衡向逆向移动;
(4)燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成氧化物N2O5的电极,再根据离子的放电顺序写出电极反应式;
(5)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,越弱越水解判断;反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{H}_{4}^{+})c(HC{O}_{3}^{-})}$=$\frac{c({H}^{+})c(O{H}^{-})}{K(N{H}_{3}•{H}_{2}O){K}_{1}}$进行计算.
解答 解:(1)二氧化碳是碳原子和氧原子间通过共价双键形成的非极性分子,碳原子和氧原子均达到了8电子稳定结构,故答案为: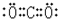 ;
;
(2)①2NH3(g)+CO2(g)=NH2CO2 NH4(s)△H=+l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=-116.5kJ•mol-1
③H2O(l)=H2O(g)△H=-44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0KJ/mol;
(3)145℃到900℃时,NO产率随温度升高而增大;对于放热反应,温度升高,则化学平衡向逆向移动,所以氨气的产率减小,
故答案为:145℃到900℃时,NO产率随温度升高而增大;温度高于900℃时,平衡向左移动;
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,二氧化氮在负极失电子发生氧化反应,元素化合价升高为+5价,氧化物为N2O5,反应的电极反应为:NO2+NO3--e-=N2O5;
故答案为:NO2+NO3--e-=N2O5;
(5)根据盐类水解规律,已知NH3.H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,所以碳酸氢根的水解程度更大,所以NH4HCO3显碱性;反应NH4++HCO3-+H2O═NH3.H2O+H2CO3的平衡常数K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{H}_{4}^{+})c(HC{O}_{3}^{-})}$=$\frac{c({H}^{+})c(O{H}^{-})}{K(N{H}_{3}•{H}_{2}O){K}_{1}}$=$\frac{1{0}^{-14}}{1.75×1{0}^{-5}×4.4×1{0}^{-7}}$=1.3×10-3;
故答案为:碱性;1.3×10-3.
点评 本题考查了电子式、盖斯定律的应用、电化学和弱电解质的电离平衡,综合性较强,但难度较大.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2比Na20化学性质稳定 | |
| B. | 均与水反应生成NaOH,因而均是碱性氧化物 | |
| C. | Na20能被氧化成Na2O2 | |
| D. | 均可与H2O、CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2含有的氯原子数为0.1NA | |
| B. | 3.4 g NH3含有的分子数为0.2NA | |
| C. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| D. | 100 mL 0.1 mol/L的Na2SO4溶液中,Na+数为0.01 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用漂白粉给游泳池的水消毒 | B. | 袋装食品装人硅胶防潮 | ||
| C. | 用小苏打烹制面包 | D. | 袋装食品装人铁粉作抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在配制过程中玻璃棒的作用是搅拌和引流 | |
| B. | 用到的仪器有250 mL容量瓶、托盘天平、量筒、烧杯、玻璃棒和胶头滴管 | |
| C. | 浓硫酸在烧杯中稀释后,立即转移到容量瓶进行后续操作,所配溶液浓度偏高 | |
| D. | 液面离容量瓶刻度线1~2cm时,应改用胶头滴管滴加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
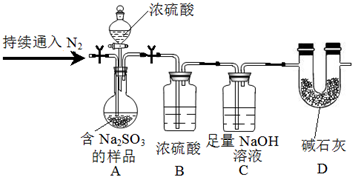
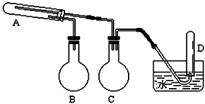 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )| A. | 实验进行时试管A中应加入的试剂是普通铁粉 | |
| B. | 烧瓶B的作用是防止倒吸,烧瓶C的作用是产生水蒸气 | |
| C. | 试管D中收集得到的是H2 | |
| D. | 3 mol单质Fe全部转变为Fe3O4,失去8 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
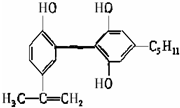 我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式为,有关该物质的说法不正确的是( )
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式为,有关该物质的说法不正确的是( )| A. | 遇FeCl3溶液显紫色 | |
| B. | 1 mol 该物质与浓溴水和H2反应时最多消耗Br2和H2的量分别为4 mol、7 mol | |
| C. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明结构中存在碳碳双键 | |
| D. | 该分子能和NaOH反应,因为该物质与苯酚一样,都有酚羟基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com