
”¾ĢāÄæ”æČ¼ĮĻµē³ŲŹĒČ¼ĮĻ£ØČēCO”¢H2”¢CH4£©µČøśO2£Ø»ņæÕĘų£©Ęš·“Ó¦½«»ÆѧÄÜ×Ŗ±äĪŖµēÄܵÄ×°ÖĆ£¬µē½āÖŹČÜŅŗŹĒĒæ¼ī£ØČēKOH£©ČÜŅŗ£¬ĻĀĮŠ¹ŲÓŚ¼×ĶéČ¼ĮĻµē³ŲµÄĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø””””£©
A.ĶØČėŃõĘųµÄŅ»¼«·¢Éś»¹Ō·“Ó¦£¬ĶØČė¼×ĶéµÄŅ»¼«·¢ÉśŃõ»Æ·“Ó¦
B.øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖCH4+10OH©©8e©ØTCO ![]() +7H2O
+7H2O
C.Ėę×Å·“Ó¦µÄ½ųŠŠ£¬µē½āÖŹČÜŅŗµÄpH±£³Ö²»±ä
D.¼×ĶéČ¼ĮĻµē³ŲµÄÄÜĮæĄūÓĆĀŹ±Č¼×ĶéČ¼Éյēó
”¾“š°ø”æC
”¾½āĪö”æ½ā£ŗA”¢ĶØČėŃõĘųµÄŅ»¼«·¢Éś»¹Ō·“Ó¦£¬ĶØČė¼×ĶéµÄŅ»¼«·¢ÉśŃõ»Æ·“Ó¦£¬¹ŹAÕżČ·£»
B”¢Õż¼«·“Ó¦ĪŖO2+2H2O+4e©=4OH©£»×Ü»Æѧ·½³ĢŹ½ĪŖ£ŗCH4+2O2+2OH©=CO32©+3H2O£»×Ü·“Ó¦¼õČ„Õż¼«·“Ó¦µĆµ½øŗ¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗCH4+10OH©©8e©ØTCO32©+7H2O£»¹ŹBÕżČ·£»
C”¢Ėę×Ų»¶Ļ·Åµē£¬Ōµē³Ų·“Ó¦ÖŠ·“Ӧɜ³ÉĖ®£¬ĒāŃõøłĄė×ÓÅØ¶Č¼õŠ”£¬µē½āÖŹČÜŅŗµÄpH¼õŠ”£¬¹ŹC“ķĪó£»
D”¢¼×ĶéČ¼ĮĻµē³ŲŹµĻÖ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ£¬µē³Ų·“Ó¦µÄÄÜĮæĄūÓĆĀŹ±Č¼×ĶéČ¼Éյē󣬹ŹDÕżČ·£»
¹ŹŃ”C£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³ŃŠ¾æŠ”×éĢ½¾æµē½āFeCl2ČÜŅŗµÄµē¼«·“Ó¦²śĪļ
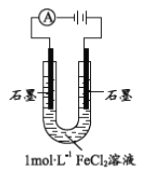
£Ø1£©ÅäÖĘ1molL-1FeCl2ČÜŅŗ£¬²āµĆpH=4.91£¬ŌŅņ______£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©”£“Ó»ÆŗĻ¼Ū½Ē¶Č·ÖĪö£¬ Fe2+¾ßÓŠ________”£
£Ø2£©øĆŠ”×éĶ¬Ń§Ō¤²āµē½āFeCl2ČÜŅŗĮ½¼«µÄĻÖĻó£ŗŃō¼«ÓŠ»ĘĀĢÉ«ĘųĢå²śÉś£¬Ņõ¼«ÓŠĪŽÉ«ĘųĢå²śÉś”£
øĆŠ”×éĶ¬Ń§ÓĆÓŅĶ¼×°ÖƵē½ā1molL-1FeCl2ČÜŅŗ£ŗ
¢ŁČ”ÉŁĮæŅų»ŅÉ«¹ĢĢåĻ“µÓŗ󣬼ÓĻ”H2SO4ÓŠĘųÅŻ²śÉś£¬ŌŁĻņČÜŅŗÖŠ¼ÓČė________£ØŹŌ¼ĮŗĶĻÖĻ󣩣¬Ö¤Ć÷øĆ¹ĢĢåĪŖFe”£
¢ŚøĆŠ”×éĶ¬Ń§½ųŅ»²½·ÖĪöŗģŗÖÉ«¹ĢĢå²śÉśµÄŌŅņ£¬¼×Ķ¬Ń§ČĻĪŖ________£»ŅŅĶ¬Ń§ČĻĪŖ2Cl- - 2e- = Cl2”ü£¬Cl2æÉŃõ»ÆFe2+×īÖÕÉś³ÉFe£ØOH£©3 ”£
ĪŖÖ¤Źµ½įĀŪ£¬Éč¼Ę·½°øČēĻĀ£ŗÓĆŹµŃé¢ńµÄ×°ÖĆŗĶ1.5v µēŃ¹£¬µē½āĖį»Æ£ØpH=4.91£©µÄ_______£¬Ķصē5·ÖÖÓŗó£¬Ńō¼«ĪŽĆ÷ĻŌĻÖĻó£¬Ö¤ŹµŅŅĶ¬Ń§µÄĶĘĀŪ²»ÕżČ·”£±ūĶ¬Ń§ČĻĪŖČŌ²»ŃĻ½÷£¬ŌŅņŹĒ²śÉśµÄĘųĢåČÜÓŚĖ®£¬¼ĢŠųŹµŃé________£Ø²Ł×÷ŗĶĻÖĻ󣩣¬½ųŅ»²½Ö¤ŹµĮĖŅŅĶ¬Ń§µÄĶĘĀŪ²»ÕżČ·”£
£Ø3£©øĆŠ”×éĶ¬Ń§½ųŅ»²½Ģ½¾æµē½ā1molL-1FeCl2ČÜŅŗµē¼«²śĪļµÄÓ°ĻģŅņĖŲ”£
ŹµŃé | Ģõ¼ž | ²Ł×÷¼°ĻÖĻó | ||
µēŃ¹ | pH | Ńō¼« | Ņõ¼« | |
¢ń | 1.5v | 4.91 | ĪŽĘųÅŻ²śÉś£¬ČÜŅŗÖš½„±ä»ė×Ē£¬5·ÖÖÓŗóµē¼«±ķĆęĪö³öŗģŗÖÉ«¹ĢĢå | ĪŽĘųÅŻ²śÉś£¬4·ÖÖÓŗóµē¼«±ķĆęÓŠŅų»ŅÉ«½šŹōד¹ĢĢåø½×Å |
¢ņ | 1.5v | 2.38 | ĪŽĘųÅŻ²śÉś£¬ČÜŅŗ³öĻÖÉŁĮæ»ė×Ē£¬µĪ¼ÓKSCNČÜŅŗ±äŗģÉ« | ĪŽĘųÅŻ²śÉś£¬µē¼«±ķĆęÓŠŅų»ŅÉ«½šŹōד¹ĢĢåø½×Å |
¢ó | 1.5v | 1.00 | ĪŽĘųÅŻ²śÉś£¬ČÜŅŗĪŽ»ė×ĒĻÖĻ󣬵Ī¼ÓKSCNČÜŅŗ±äŗģÉ« | ÓŠĘųÅŻ²śÉś£¬ĪŽ¹ĢĢåø½×Å |
¢ō | 3.0v | 4.91 | ĪŽĘųÅŻ²śÉś£¬ČÜŅŗÖš½„±ä»ė×Ē£¬3·ÖÖÓŗóµē¼«±ķĆęÓŠŗģŗÖÉ«¹ĢĢå²śÉś | ¼«ÉŁĮæĘųÅŻ²śÉś£¬1·ÖÖÓ³öĻÖ¶Ę²ć½šŹō |
¢õ | 6.0v | 4.91 | ÓŠĘųÅŻ²śÉś£¬ÓöŹŖČóµÄµķ·Ūµā»Æ¼ŲŹŌÖ½±äĄ¶”£ČÜŅŗÖš½„±ä»ė×Ē | “óĮæĘųÅŻ²śÉś£¬ŃøĖŁ³öĻÖ¶Ę²ć½šŹō |
¢Ł¶Ō±ČŹµŃé¢ń”¢¢ņ”¢¢óæÉŅŌµĆ³ö½įĀŪ£ŗ
Ńō¼«Fe2+·ÅµēŹ±£¬ĖįŠŌ½ĻĒæÖ÷ŅŖÉś³ÉFe3+£» ĖįŠŌ½ĻČõÖ÷ŅŖÉś³ÉFe£ØOH£©3 ”£Ņõ¼«________”£
¢Ś¶Ō±ČŹµŃé¢ń”¢¢ō”¢¢õæÉŅŌµĆ³ö½įĀŪ£ŗ
Ōö“óµēŃ¹£¬²»½öæÉŅŌøıäĄė×ӵķŵēÄÜĮ¦£¬Ņ²æÉŅŌ________”£
£Ø4£©×ŪŗĻ·ÖĪöÉĻŹöŹµŃ飬µē½ā¹ż³ĢÖŠµē¼«·“Ó¦µÄ²śĪļÓė________ÓŠ¹Ų ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·“Ó¦4A(s)+3B(g)==2C(g)+D(g)£¬¾2minŗóBµÄÅØ¶Č¼õÉŁ0.6mol”¤L-1£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ÓĆA±ķŹ¾µÄ·“Ó¦ĖŁĀŹŹĒ0.4mol”¤L-1”¤min-1
B. ŌŚ2minÄ©µÄ·“Ó¦ĖŁĀŹ£¬ÓĆB±ķŹ¾ŹĒ0.3 mol”¤L-1”¤min-1
C. ·Ö±šÓĆB”¢C”¢D±ķŹ¾·“Ó¦µÄĖŁĀŹ£¬Ęä±ČÖµŹĒ3:2:1
D. ŌŚÕā2minÄŚBŗĶCĮ½ĪļÖŹÅØ¶ČŹĒÖš½„¼õŠ”µÄ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£ØŅŌ±ūĶéĪŖČ¼ĮĻÖĘ×÷ŠĀŠĶČ¼ĮĻµē³Ų£¬µē³ŲµÄÕż¼«ĶØČėO2ŗĶCO2 £¬ øŗ¼«ĶØČė±ūÉÕ£¬µē½āÖŹŹĒČŪČŚĢ¼ĖįŃĪ£¬µē³Ų×Ü·“Ó¦·½³ĢŹ½ĪŖ£ŗC3H8+5O2ØT3CO2+4H2O£®
£Ø1£©ŅŃÖŖ£ŗ2C3H8£Øg£©+7O2£Øg£©ØT6CO£Øg£©+8H2O£Øl£©”÷H1C£Øs£©+O2£Øg£©ØTCO2£Øg£©”÷H2
2C£Øs£©+O2£Øg£©ØT2CO£Øg£©”÷H3
Ōņ C3H8£Øg£©+5O2£Ø£Øg£©ØT3CO2£Øg£©+4H2O£Øl£©”÷H=£ØÓĆ”÷H1”¢”÷H2”¢”÷H3±ķŹ¾£©
£Ø2£©Š“³öøƵē³ŲÕż¼«µÄµē¼«·“Ó¦Ź½£ŗ£¬µē³Ų¹¤×÷Ź±CO32©ŅĘĻņ£ØĢī”°Õż¼«”±»ņ”°øŗ¼«”±£©£»ÓĆøƵē³Ųµē½ā1000mL lmol/LµÄAgNO3ČÜŅŗ£Ø¶čŠŌµē¼«£©£¬“Ėµē½ā³ŲµÄ·“Ó¦·½³ĢŹ½ĪŖ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æQ”¢X”¢YŗĶZĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬ĖüĆĒŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬Õā4ÖÖŌŖĖŲµÄŌ×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ22”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. QµÄµ„ÖŹ¾ßÓŠ°ėµ¼ĢåµÄŠŌÖŹ£¬QÓėZæÉŠĪ³É»ÆŗĻĪļQZ4
B. QµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄĖįŠŌ±ČZµÄĒæ
C. X”¢YŗĶĒā3ÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÖŠ¶¼Ö»ÓŠ¹²¼Ū¼ü
D. YµÄŌ×Ó°ė¾¶±ČXµÄ“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚø÷×°ÖĆĶ¼µÄŠšŹöÖŠ£¬²»ÕżČ·µÄŹĒ£Ø””””£©
A.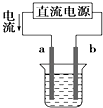 ČēĶ¼×°ÖĆÖŠaĪŖŃō¼«”¢bĪŖŅõ¼«
ČēĶ¼×°ÖĆÖŠaĪŖŃō¼«”¢bĪŖŅõ¼«
B.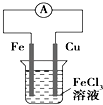 ČēĶ¼×°ÖƵÄ×Ü·“Ó¦ŹĒ£ŗCu+2Fe3+=Cu2++2Fe2+
ČēĶ¼×°ÖƵÄ×Ü·“Ó¦ŹĒ£ŗCu+2Fe3+=Cu2++2Fe2+
C.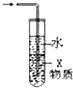 ČēĶ¼×°ÖĆÖŠXČōĪŖĖÄĀČ»ÆĢ¼£¬æÉÓĆÓŚĪüŹÕ°±Ęų»ņĀČ»ÆĒā£¬²¢·ĄÖ¹µ¹Īü
ČēĶ¼×°ÖĆÖŠXČōĪŖĖÄĀČ»ÆĢ¼£¬æÉÓĆÓŚĪüŹÕ°±Ęų»ņĀČ»ÆĒā£¬²¢·ĄÖ¹µ¹Īü
D. ČēĶ¼×°ÖĆÖŠµÄĢś¶¤¼øŗõ²»±»øÆŹ“
ČēĶ¼×°ÖĆÖŠµÄĢś¶¤¼øŗõ²»±»øÆŹ“
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬Ļņ100mL 0.01molL©1µÄHAČÜŅŗÖŠÖšµĪ¼ÓČė0.02molL©1µÄMOHČÜŅŗ£¬Ķ¼ÖŠĖłŹ¾ĒśĻß±ķŹ¾»ģŗĻČÜŅŗµÄpHµÄ±ä»ÆĒéæö£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£© 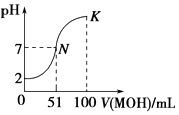
A.HAĪŖČõĖį
B.³£ĪĀĻĀ£¬MAČÜŅŗµÄpH£¾7
C.Kµć¶ŌÓ¦µÄČÜŅŗÖŠ£ŗc£ØM+£©+c£ØMOH£©=c£ØA©£©
D.ŌŚNµ½K¼äČĪŅāŅ»µć¶ŌÓ¦µÄČÜŅŗÖŠ£ŗc£ØM+£©+c£ØH+£©=c£ØOH©£©+c£ØA©£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫FeCl3”¢CuCl2»ģŗĻČÜŅŗ¼ÓČėŅ»¶ØÖŹĮæµÄĢś·ŪÖŠ³ä·Ö·“Ó¦£¬Ėł¼Ó»ģŗĻČÜŅŗµÄĢå»żÓė·“Ó¦ŗóŹ£Óą¹ĢĢåÖŹĮæČēĶ¼ĖłŹ¾”£ŅŃÖŖŌ»ģŗĻČÜŅŗÖŠFe3+ÅضČĪŖ0.200 mol/L£¬¾¼ģ²āMµćŹ±ČÜŅŗÖŠĪŽCu2+£»
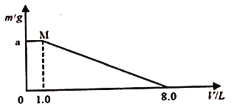
Ēó£ŗ
£Ø1£©c(CuCl2 )=______mol”¤L£1”£
£Ø2£©Ģś·ŪµÄÖŹĮæ_______g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢EŹĒŗĖµēŗÉŹżŅĄ“ĪŌö“óµÄĪåÖÖ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£¬AŌŖĖŲµÄŌ×ÓŗĖÄŚÖ»ÓŠ1øöÖŹ×Ó£¬BŌŖĖŲµÄŌ×Ó°ė¾¶ŹĒĘäĖłŌŚÖ÷×åÖŠ×īŠ”µÄ£¬BµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄ»ÆѧŹ½ĪŖHBO3£»CŌŖĖŲŌ×ÓµÄ×īĶā²ćµē×ÓŹż±Č“ĪĶā²ć¶ą4øö£»CµÄŅõĄė×ÓÓėDµÄŃōĄė×Ó¾ßÓŠĻąĶ¬µÄµē×ÓÅŲ¼£¬Į½ŌŖĖŲæÉŠĪ³É»ÆŗĻĪļD2C£»C”¢EĶ¬Ö÷×唣
£Ø1£©DŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ___________£»
£Ø2£©ŌŖĖŲC”¢D”¢EŠĪ³ÉµÄŌ×Ó°ė¾¶“󊔹ŲĻµŹĒ______________£ØÓĆŌŖĖŲ·ūŗűķŹ¾£©”£
£Ø3£©C”¢DæÉŠĪ³É»ÆŗĻĪļD2C2£¬D2C2ŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶÓŠ______________________£»
£Ø4£©A”¢CĮ½ÖÖŌŖĖŲŠĪ³ÉµÄŌ×ÓøöŹżÖ®±ČĪŖ1:1µÄ»ÆŗĻĪļµē×ÓŹ½________________£»
£Ø5£©BµÄĒā»ÆĪļÓėBµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļ·“Ó¦µÄĄė×Ó·½³ĢŹ½_______________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com