
(12分)有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
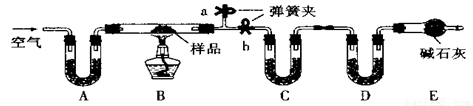
(1)实验时,B中发生反应的化学方程式为 , 。
(2)装置C、D中盛放的试剂分别为:
C ,D (供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是 ,它在该实验中的主要作用是
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”、“偏低”或“无影响”)。
(5)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3·10H2O的质量分数为: (结果用分数表示,可不化简)。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有一澄清的碱性溶液,作离子鉴定时得出的结论是含有:AlO2-、Fe3+、HCO3- | B、某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | C、固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中含较多的HCO3- | D、某溶液中加入BaCl2出现不溶于稀HNO3的白色沉淀,则该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
计算题(每题3分,共9分)(1)浓度不等的两种硫酸溶液等质量混合时,其质量分数为a%,而等体积混合时为b%;浓度不等的两种乙醇溶液等质量混合后,其质量分数为a%,而等体积混合时则为c%。则a、b、c由大到小排序为
(2)由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
(3) 有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为 mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com