
【题目】实验室可用KMnO4和浓盐酸反应制取氯气:KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)。
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目____________。
(2)将上述配平的化学方程式改写为离子方程式________________________。
(3)浓盐酸在反应中显示出来的性质是____________。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生0.5 mol Cl2,则被氧化的HCl_______mol,转移的电子的数目约为____。
(5)一定条件下,KMnO4还可以氧化其他还原性物质。__MnO4-+ C2O42-+ = Mn2++ CO2↑+ ,完成上述离子方程式,此反应中,发生氧化反应的物质是______;若转移1 mol电子,生成标准状况下CO2_____L。
【答案】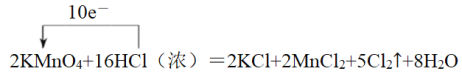 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O ② 1 NA 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O C2O42- 22.4
2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O ② 1 NA 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O C2O42- 22.4
【解析】
(1)反应KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(未配平)中,Mn元素的化合价由+7降低为+2价,Cl元素的化合价由-1价升高到0,化合价升高数=化合价降低数=转移电子数=10,根据电子守恒可知,MnCl2的化学计量数为2,Cl2的化学计量数为5,再根据质量守恒定律可知,配平的化学反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,单线桥表示反应中电子转移的方向和数目为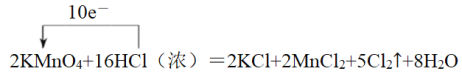 ;
;
(2)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,改为离子反应时Cl2和H2O应保留化学式,其余物质均写成离子形式,则离子反应为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(3)由反应可知,盐酸参与反应生成KCl和MnCl2时表现其酸性,生成Cl2时表现其还原性,故答案为:②;
(4)Cl元素的化合价由-1价升高到0,产生0.5molCl2,则被氧化的HCl为0.5mol×2=1mol,转移的电子的物质的量为0.5mol×2×(1-0)=1mol,个数为NA;
(5)反应中Mn元素化合价由+7价降低为+2价,共降低5价,C元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,可以确定MnO4-的系数为2、C2O42-的系数为5,由原子守恒可知Mn2+的系数为2、CO2的系数为10,由电荷守恒可知,反应物中缺项为H+,由元素守恒可知生成物中缺项为H2O,配平后离子方程式为2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,其中C元素化合价由+3价升高为+4价,则C2O42-发生氧化反应,若转移1mol电子,生成标准状况下CO2为1mol,体积为22.4L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
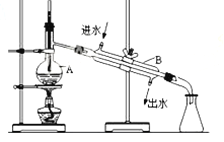
(1)指出图中明显的错误________________;________________;
(2)A仪器的名称是________________;B仪器的名称是________________;
(3)萃取、分液实验中所用主要玻璃仪器的名称是________________,静置后分液的第一步操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】罗马大学Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构如右图所示(与白磷P4相似)。已知断裂1 mol N—N键吸收167 kJ热量,生成 1 mol N≡N键放出 942 kJ 热量。由此判断下列说法正确的是( )
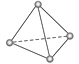
A. N4属于一种新型的化合物 B. N4与N2互为同分异构体
C. N4沸点比P4(白磷)高 D. 1 mol N4气体转变为N2将放出882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol/L NaOH溶液中加入0.2 mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )

A. 在B点有:c(Na+)=c(CH3COO-)
B. 对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应中的能量变化,表述正确的是 ( )
A. 中和反应是吸热反应
B. 燃烧属于放热反应
C. 断开化学键的过程会放出能量
D. 加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1 的较浓氨水沿玻璃棒加人到u mL水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀氨水。若c1 =2c2,则:
A. w1>2w2,u>50 B. w1<2w2,u<50 C. w1=2w2,u<50 D. w1<2w2,u>50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)44.4g某二价金属的氯化物中含有0.8molCl-,该金属的相对原子质量为_______ 。
(2)如果mg氨气由a个原子构成,则2mg硫化氢中含有的分子数为__________(用含a的代数式表示)。
(3)0.2mol的单质Ax和1.2molB2完全反应,生成0.8mol的AB3,则单质Ax的化学式是_____________。
(4)现有未知浓度的盐酸25mL,能跟20mL某浓度的氢氧化钠溶液完全反应。若先用0.1g碳酸钙与25mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4mL才能中和。氢氧化钠溶液的物质的量浓度为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com