

分析 (1)净化除去悬浮杂质,软化除去水中钙、镁离子;
(2)①先沉淀、再过滤,最后消毒处理;
②对自来水进行杀菌消毒,且不会造成二次污染,只有臭氧的还原产物对水无污染;
(3)①将待处理水的pH调到9左右,再加入绿矾,可得到铁离子,水解生成胶体;
②发生氧化还原反应生成Na2FeO4;
(4)Na2CO3溶液的浓度为2.8×10-5mol/L,等体积混合后溶液中c(CO32-)=1.4×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),以此来解答.
解答 解:(1)水的净化和软化的区别是水的净化是用混凝剂将水中的胶体及悬浮物沉淀下来,而水的软化是除去水中较多的钙离子和镁离子,
故答案为:水的净化是用混凝剂将水中的胶体及悬浮物沉淀下来,而水的软化是除去水中较多的钙离子和镁离子;
(2)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是混凝沉淀→过滤→杀菌消毒,故答案为:混凝沉淀→过滤→杀菌消毒;
②福尔马林有毒,含氯物质可导致二次污染,则能够用来对自来水进行杀菌消毒,且不会造成二次污染的只有臭氧,故答案为:d;
(3)①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加绿矾,原因:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-=4Fe(OH)3(胶体),
故答案为:Fe2+在碱性条件下易被氧化成Fe3+,进而水解生成Fe(OH)3胶体,起到较好的混凝作用,4Fe2++O2+2H2O+8OH-═4Fe(OH)3(胶体);
②由Fe(0H)3制取Na2FeO4的化学方程式为2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,
故答案为:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;
(4)Na2CO3溶液的浓度为5.6×10-5mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×5.6×10-5mol/L=2.8×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{2.8×1{0}^{-5}}$mol/L=1×10-4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10-4mol/L=2×10-4mol/L,故答案为:2×10-4mol/L.
点评 本题考查较综合,涉及混合物分离提纯、溶度积的计算、氧化还原反应及应用等,注重高频考点的考查,综合性较强,综合考查学生的分析、实验和计算能力,题目难度较大,注意化学与生活的联系.


科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 ;
;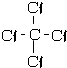 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2洛液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| B. | Cl2通入水中:Cl2+H20═2H++Cl-+ClO- | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H20═2Cu+O2+4H+ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使S042-恰好完全沉淀:2Ba2++3OH-+Al3++2S042-═2BaS04+Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.5 |
| SO42- | 3.5 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
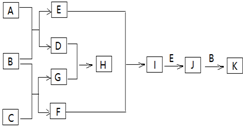 有关物质的转化关系如图所示(部分物质与条件已略去).已知A为淡黄色固体,B为常见的无色液体,C为两种元素组成的化合物,摩尔质量为150g/mol,E为单质气体,F为气态氢化物,有臭鸡蛋气味,G为两性氢氧化物,K为常见的酸.
有关物质的转化关系如图所示(部分物质与条件已略去).已知A为淡黄色固体,B为常见的无色液体,C为两种元素组成的化合物,摩尔质量为150g/mol,E为单质气体,F为气态氢化物,有臭鸡蛋气味,G为两性氢氧化物,K为常见的酸. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ):
):
 、F
、F .
. 、⑨
、⑨ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com