
对下列电解质溶液的叙述错误的是( )
A. 等物质的量浓度的Na2CO3和NaHCO3混合液中:
c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+)
B. 25℃时 0.2 mol•L﹣1盐酸与等体积0.05 mol.L﹣1Ba(OH)2溶液混合后,溶液的pH=l
C. 25℃时,pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2﹣)+c(HR﹣)=c(Na+)
D. 25℃时,若0.3 mol.L﹣1 HY溶液与0.3 mol.L﹣lNaOH溶液等体积混合后,溶液的pH=9,则:c(OH﹣)﹣c(HY)=1×lO﹣9 mol.L﹣1
科目:高中化学 来源: 题型:
NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题
(1)NO的危害在于
a.破坏臭氧层 b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合 d.当它转化为N2后使空气中O2含量降低
(2)在含有Cu+的酶的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+和NO2-在酸性溶液中转化为NO的离子方程式 ________________________ 。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,方程式为
(4)将0.05molNO、0.03molO2的混合气体以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为(设溶液体积变化忽视不计) _________
(5)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体。若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法。
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
| ③ | H2 | CO2 | 通过盛有NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
正确的一组是( )
A.①②③④ B.③④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别( )
A. 2 mol、3 mol、6 mol
B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol
D. 3 mol、2 mol、2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( )
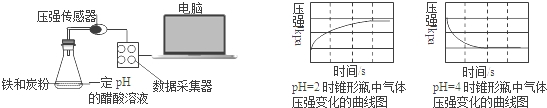
A. 溶液pH≤2时,生铁发生析氢腐蚀 B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 析氢腐蚀和吸氧腐蚀的速率一样快 D. 两溶液中负极反应均为:Fe﹣2e﹣=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1) NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
(1)软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
 (2)除去反应混合物中的不溶物
(2)除去反应混合物中的不溶物
(3)电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是 ( )
A.步骤⑴中每析出12.8g S沉淀共转移0.4mol电子
B.步骤⑴中ZnS的还原性大于MnSO4的还原性
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
在CH3COCH3中,中间碳原子和两边碳原子成键所采用的杂化方式分别是( )
A.sp2杂化、sp3杂化 B.sp3杂化、sp3杂化
C.sp2杂化、sp2杂化 D.sp杂化、sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程中所发生的化学反应属于酯化反应的是( )
|
| A. | 在浓硫酸、加热条件下,乙醇和乙酸反应 |
|
| B. | 乙醇使酸性高锰酸钾褪色 |
|
| C. | 在铁粉存在的条件下,苯与液溴反应 |
|
| D. | 甲烷与氯气在光照条件下反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com