
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
分析 (1)工业制硫酸是在沸腾炉中燃烧黄铁矿,煅烧时与O2反应生成Fe2O3和SO2;
(2)接触法制硫酸的过程中,接触室内为提高SO2的转化率通常会增加氧气的量,吸收塔内是用98.3%的浓硫酸吸收SO3得到发烟硫酸,结合原子利用率可知黄铁矿的损失与S的损失率等同,SO2的催化氧化是放热反应,升高温度可以提高反应速率,但平衡左移,反应物的转化率降低;
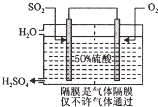
(3)利用原电池原理制硫酸溶液,通O2的极为正极,电极反应为O2+4e-+4H+=2H2O,通SO2的极为了负极,电极反应为2SO2-4e-+4H2O=2SO42-+8H+,结合正负极得失电子是相等的,即得原电池反应:2SO2+O2+2H2O=2H2SO4,根据稀硫酸溶液的质量分数是50%,假设溶液里硫酸的质量为98g,据此可计算出通入SO2的质量和水的质量比;
(4)接触室发生的反应为2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0,升高温度平衡逆向移动,反应物的转化率降低,从图表中可以看出,恒温时增大压强平衡正向移动,但反应物的转化率变化幅度不大,但压强的增大消耗能源及对设备的要求也高,故不易高压,综合考虑可选择适宜温度和压强;
(5)①尾气中的二氧化硫是酸雨的主要来源和重要的化工原料,随意排放既污染大气,也是一种资源浪费,故对尾气要净化回收,选择处理方法时可以从原料的成本和资源等方面考虑;
②结合关系式关系式CaO~Ca(OH)2~SO2~CaSO3计算.
解答 解:(1)黄铁矿的主要成分为FeS2,煅烧时与O2反应生成Fe2O3和SO2,化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;黄铁矿煅烧的设备是沸腾炉;
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;沸腾炉;
(2)A、SO2转化为SO3在接触室中进行,故A错误;
B、吸收塔是利用98.3%的浓硫酸吸收SO3得到的是发烟硫酸,故B错误;
C、煅烧黄铁矿的过程是化学变化,遵守原子守恒,黄铁矿和S的利用率相等,若黄铁矿损失了2%,则S损失2%,故C正确;
D、接触室中采取高温是为了提高催化剂的活性,没有提高SO2的转化率,原因此反应是放热反应,升高温度平衡逆向移动,SO2的转化率反而会降低,故D错误;
故选C;
(3)利用原电池氧化SO2制硫酸的总反应式:2SO2+O2+2H2O=2H2SO4,根据稀硫酸溶液的质量分数是50%,假设溶液里硫酸的质量为98g,溶液里水的质量也为98g,生成的硫酸的物质的量为$\frac{98g}{98g/mol}$=1mol,结合原电池反应式可知参加反应的SO2和H2O的物质的量也为1mol,则SO2的质量为1mol×64g/mol=64g,水的质量为1mol×18g/mol=18g,通入通入SO2的质量和水的质量比为$\frac{98g}{18g+98g}$=16﹕29;
故答案为:16﹕29;
(4)因为SO2与O2的反应是放热反应,温度高,平衡逆向移动,所以选择的温度为400℃,而1个标准大气压时SO2的转化率已经很大,再增大压强,SO2的转化率提高不大,但会增加生产成本,所以选择1个标准大气压;
故答案为:400℃,1个标准大气压;
(5)①通常用足量石灰水吸收尾气中的SO2生成CaSO3,然后再用稀硫酸处理CaSO3得到纯净的SO2和CaSO4,SO2可重新用来制硫酸,CaSO4制石膏,达到变废为宝的目的,另一方面制石灰水的生石灰成本也低,资源也丰富;
故答案为:原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可再利用作为原料;
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,则n(SO2)=$\frac{10000×0.2%×1{0}^{3}L}{22.4L/mol}$=893mol,由关系式CaO~Ca(OH)2~SO2~CaSO3可知,需要893molCaO,质量为893mol×56g/mol=50000g=50kg;
故答案为:50.
点评 本题考查了工业制硫酸的生成过程和反应特征,二氧化硫的催化氧化反应的条件选择,尾气吸收的方法判断,二氧化硫接触室催化氧化反应的平衡移动,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CHO能发生取代反应、加成反应、氧化反应 | |
| B. | 乙醇醛糖是一种有机物,能燃烧,可溶于水 | |
| C. | HOCH2CHO与乙酸、甲酸甲酯互为同分异构体 | |
| D. | 乙醇醛糖与葡萄糖具有相似的化学性质,且互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: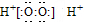 | |
| B. | 氮原子最外层电子轨道表达式: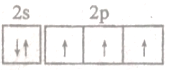 | |
| C. | Cl中子数为18的氯原子结构示意图: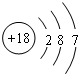 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3?Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4(H+)、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 等物质的量的SO2和Cl2相遇在溶液中具有漂白能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L苯中含有NA个苯分子 | |
| B. | 14g N2含有的核外电子总数为14NA | |
| C. | 1 mol乙炔分子含3NA个碳碳叁键 | |
| D. | 23g金属钠与足量水反应时失去的电子数是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为35的氯原子:${\;}_{35}^{17}$Cl | B. | 16O与18O互为同位素 | ||
| C. | 氯离子的结构示意图: | D. | NaClO的电子式: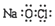 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com