
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
(1)I.某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?(填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 , 反应的离子方程式为 .
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是(填序号).
A.浓硫酸
B.稀硫酸
C.稀硝酸
D.氢氧化钠溶液
(4)Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入6molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题: 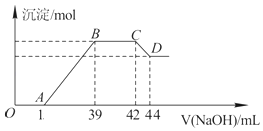
依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:
(5)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为 .
(6)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为;
(7)熔融物中铝元素的物质的量为mol.
(8)B点对应的沉淀的物质的量为mol,A点对应的氢氧化钠溶液的体积为mL.
【答案】
(1)合理
(2)NaOH溶液;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
(3)B
(4)8Fe+3OH++3NO3﹣═8 Fe3++3NH4++9 H2O
(5)H++OH﹣═H2O
(6)NH4++OH﹣═NH3?H2O
(7)0.012
(8)0.048;15
【解析】解:Ⅰ.:(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,所以铝热反应所得到的熔融物应是铁铝合金,
所以答案是:合理;(2)铝与NaOH溶液反应生成气体,反应的化学方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以可用NaOH溶液检验所得的块状熔融物中含有金属铝,
所以答案是:NaOH溶液;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;(3)A.浓硫酸易使铁、铝钝化,不能使合金溶解,故A错误;
B.活泼金属与稀硫酸反应,熔融物可溶解于稀硫酸中,故B正确;
C.稀硝酸与金属反应生成污染性气体,不是最佳选择,故C错误;
D.铁不与NaOH溶液反应,不能将熔融物全部溶解,故D错误.
所以答案是:B;
Ⅱ.(4)熔融物与稀硝酸反应过程中气体产生,可推断出还原产物应为NH4+,所以铁与该稀的硝酸反应的离子方程式为8Fe+3OH++3NO3﹣═8 Fe3++3NH4++9 H2O,
所以答案是:8Fe+30H++3NO3﹣═8 Fe3++3NH4++9 H2O;(5)OA 之间没有沉淀生成,说明硝酸过量,OA 之间发生的是硝酸和氢氧化钠的中和反应,离子方程式为H++OH﹣═H2O,
所以答案是:H++OH﹣═H2O;(6)BC段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,离子方程式为NH4++OH﹣═NH3H2O,
所以答案是:NH4++OH﹣═NH3H2O;(7)CD段发生的反应是Al(OH)3 +OH﹣=AlO2﹣+2H2O,n(NaOH)=0.002L×6mol/L=0.012mol,则n(Al(OH)3)=0.012mol,即熔融物中铝元素的物质的量为0.012mol,
所以答案是:0.012;(8)由8Fe+30H++3NO3﹣═8 Fe3++3NH4++9 H2O、8Al+30H++3NO3﹣═8 Al3++3NH4++9 H2O、NH4++OH﹣═NH3H2O可得关系式8(Fe和Al)~3NH4+~3OH﹣,BC段消耗的OH﹣的物质的量为6molL﹣1×(42﹣39)×10﹣3L=0.018mol,则Fe和Al的物质的量之和为0.018mol× ![]() =0.048mol,所以B点对应的沉淀Fe(OH)3和Al(OH)3的物质的量为0.048mol,AB段消耗的氢氧化钠溶液物质的量为0.048mol×3=0.144mol,AB段消耗的氢氧化钠的体积为
=0.048mol,所以B点对应的沉淀Fe(OH)3和Al(OH)3的物质的量为0.048mol,AB段消耗的氢氧化钠溶液物质的量为0.048mol×3=0.144mol,AB段消耗的氢氧化钠的体积为 ![]() =0.024L=24ml,所以A点对应的氢氧化钠溶液的体积为39﹣24=15,
=0.024L=24ml,所以A点对应的氢氧化钠溶液的体积为39﹣24=15,
所以答案是:0.048;15.


科目:高中化学 来源: 题型:
【题目】下列有关物质分类的说法正确的是
A. 二氧化碳、二氧化硅、一氧化碳均为酸性氧化物
B. 雾、稀豆浆、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、稀硫酸均属于电解质
D. 分子中含有两个氢原子的酸不一定是二元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 第二周期元素从C到F,非金属性逐渐增强
B. 第三周期元素从Na到Cl,原子半径逐渐增大
C. HF、HCl、HBr、HI的热稳定性依次逐渐增强
D. LiOH、NaOH、KOH的碱性依次逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)Ⅰ.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义.分析下面处理方案,回答下列问题: 
试剂2是 , 固体B是 , 通往的气体C是 . (填化学式).
(2)写出加入试剂1发生反应的离子方程式:、 .
(3)Ⅱ.综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如下图所示: 
反应①﹣⑤中,属于氧化还原反应的是(填符号).
(4)写出反应②的离子方程式 .
(5)X溶液中的主要阳离子是Na+和 .
(6)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③;④加适量盐酸;⑤(请补全缺少的实验步骤).
(7)检验纯碱样品中是否含NaCl应选用的试剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,20gH218O中含有中子数目为12NA
B.标准状况下,11.2LC2H6中含有极性键的数目为3.5NA
C.1LpH=3的CH3COOH溶液中,含有H+的数目大于10﹣3NA
D.1L1molL﹣1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着卤素原子核电荷数的增加,下列递变规律正确的是
A. 单质的熔沸点逐渐降低B. 气态氢化物的稳定性逐渐降低
C. 卤素最高价含氧酸酸性逐渐增强D. 卤素单质的氧化性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com