
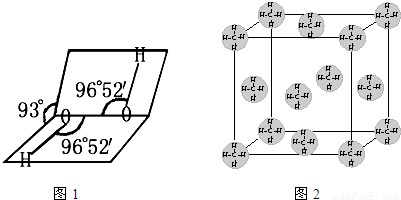
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
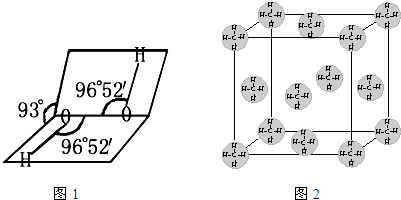
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
信 息 | 问 题 |
①X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2 | (1)根据信息①,X一定不是____________(填序号)。 A.氢 B.碳 C.氧 D.硫 |
②上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中是否可能有一种是铝元素?(填“可能”或“不可能”)____________ |
③向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀 | (3)白色沉淀物的化学式为: _____________________________ _____________________________ |
④向上述四种元素单质组成的混合物中加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀 | (4)生成白色沉淀的离子方程式为:_____ ______________________________________ |
⑤X与W同主族 | (5)X与浓硫酸反应的化学方程式为:___ ______________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(6分)阅读下面的信息,推断元素及有关物质,按要求回答:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是 (填序号)。
A氢 B. 碳 C. 氧 D. 硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,所生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素? (填可能或不可能)。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)该白色沉淀物的化学式为 。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成该白色沉淀物的离子方程式为 。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一下学期期中考试化学试卷(解析版) 题型:填空题
(6分)阅读下面的信息,推断元素及有关物质,按要求回答:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是 (填序号)。
A氢 B. 碳 C. 氧 D. 硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,所生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素? (填可能或不可能)。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)该白色沉淀物的化学式为 。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成该白色沉淀物的离子方程式为 。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com