
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
分析 A.25℃由水电离的c(H+)=10-12mol/L 的溶液中存在大量氢离子或氢氧根离子,铁离子与氢氧根离子反应;
B.使酚酞变红的溶液为碱性溶液,溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.碳酸氢根离子与铝离子发生双水解反应;
D.硝酸根离子在酸性条件下能够氧化碘离子.
解答 解:A.25℃由水电离的c(H+)=10-12mol/L 的溶液为酸性或碱性溶液,Fe3+与氢氧根离子反应,在碱性溶液中不能大量共存,故A错误;
B.使酚酞变红的溶液中存在大量氢氧根离子,Na+、Cl-、SO42-、AlO2-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.HCO3-、Al3+之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故C错误;
D.pH=1的溶液为酸性溶液,NO3-、I-之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 碘单质的升华过程中,只需克服分子间作用力 | |
| B. | NH4Cl属于离子化合物,该物质中只存在离子键 | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | 金刚石和足球烯(C60)均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
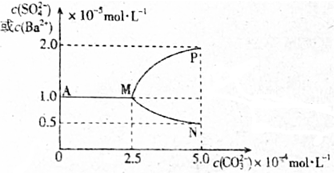
| A. | T℃时Ksp(BaSO4)<Ksp(BaCO3) | |
| B. | 当c(CO32-)大于2.5×10-4mol•L-1时开始有BaCO3沉淀生成 | |
| C. | 图象中代表沉淀转化过程中c(Ba2+)随c(CO32-)变化的曲线是MP | |
| D. | 反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与CO2反应 | D. | NaOH与HCl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硝酸银溶液与铁粉反应:2Ag++Fe═Fe2++2Ag | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的化学式为Fe2O3 | |
| B. | x=6 | |
| C. | 1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为$\frac{1}{3}$mol | |
| D. | 每生成1mol Y,反应转移的电子总数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应I2(aq)+I-(aq)?I3-(aq)△H<0 | |
| B. | 温度为T1时,向该平衡体系中加入KI固体,平衡不移动 | |
| C. | 若T1时,反应进行到状态d时,一定有v正>v逆 | |
| D. | 状态a与状态b相比,状态b时I2的转化率更低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料电池的燃料都在负极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com