
 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$ 2SO3(g)反应过程的能量变化如图所示.请回答下列问题:分析 (1)2mol二氧化硫反应放出热量为99kJ×2=198kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)①高出反应物能量为活化能,生成物与反应物之间的能量之差为焓变;
②使用催化剂降低活化能,但反应热不变;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,达平衡时测得还有0.04molL-1 SO2剩余,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):1 0.96 0
变化浓度(mol/L):0.96 0.48 0.96
平衡浓度(mol/L):0.04 0.48 0.96
转化率=$\frac{浓度变化量}{起始浓度}$×100%.
解答 解:(1)2mol二氧化硫反应放出热量为99.00kJ×2=198.00kJ,热化学方程式为:2SO2(g)十O2(g)?2SO3(g)△H=-198.00 kJ/mo1,
故答案为:2SO2(g)十O2(g)?2SO3(g)△H=-198.00 kJ/mo1;
(2)①高出反应物能量为活化能,生成物与反应物之间的能量之差为焓变;②使用催化剂降低活化能,但反应热不变,如图所示: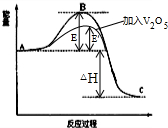 ,
,
故答案为: ;
;
(3)A.随反应进行,气体物质的量减小,恒温恒容下压强减小,容器中气体总压强不变,说明到达平衡,故A正确;
B.混合气体总质量不变,容器容积不变,容器中混合气体的密度始终不变为定值,故B错误;
C.每生成1mol SO3的同时生成1molSO2,而生成1mol SO3的同时消耗1molSO2,二氧化硫的生成速率与消耗速率相等,反应到达平衡,故C正确;
D.平衡时各组分的物质的量关系与起始物质的量及转化率有关,平衡时不一定为化学计量数之比,故D错误,
故选:AC;
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,达平衡时测得还有0.04molL-1 SO2剩余,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):$\frac{2}{2}$=1 $\frac{1.92}{2}$=0.96 0
变化浓度(mol/L):0.96 0.48 0.96
平衡浓度(mol/L):0.04 0.48 0.96
O2的转化率=$\frac{0.48mol/L}{0.96mol/L}$×100%=50%
c(SO3)平=0.96mol/L
答:平衡时O2的转化率为50%,SO3的物质的量浓度为0.96mol/L.
点评 本题考查化学平衡计算、平衡状态的判断、化学反应是能量变化、热化学方程式书写等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 先加盐酸酸化,再加BaCl2溶液 | B. | 加入盐酸酸化的BaCl2溶液 | ||
| C. | 先加BaCl2溶液,再加稀 硝酸 | D. | 加入稀盐酸酸化的Ba(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨,在茂密的树林中,可以看到从枝叶间透过的一道道光柱 | |
| B. | 工厂里用静电除尘 | |
| C. | 氨水和氯化铁溶液反应,生成氢氧化铁沉淀 | |
| D. | 不同品牌的墨水混用,导致钢笔出现堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
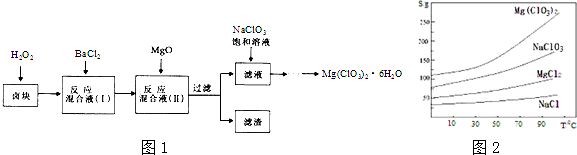
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
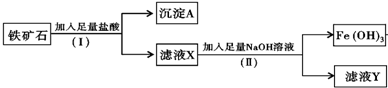
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 | |
| B. | 油脂的提纯中,可将油脂加入浓NaOH 溶液加热,然后过滤,从滤液中可得较纯的油脂 | |
| C. | 将铜丝在酒精灯上加热到红热后,立即伸入无水乙醇中,反复操作多次,可制得乙醛 | |
| D. | 淀粉用酸催化水解后的溶液加入银氨溶液,水浴加热,可看到有银镜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com