
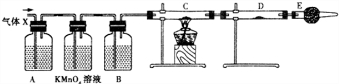
分析 (1)浓硫酸具有强氧化性,能被金属还原生成二氧化硫,则Zn和浓硫酸发生氧化还原反应生成硫酸锌、二氧化硫和水;
(2)在金属活动性顺序表中,Zn位于H元素之前,所以锌和稀硫酸反应生成硫酸锌和氢气;
(3)①二氧化硫具有漂白性,能使品红溶液褪色,所以可以用品红溶液检验二氧化硫;
②浓硫酸具有吸水性;
③氢气具有还原性,能还原部分金属氧化物,同时生成水;空气中含有水蒸气,以防止干扰实验;
(4)氢气具有还原性,能还原部分金属氧化生成水,水可以用无水硫酸铜检验,从而检验氢气.
解答 解:(1)浓硫酸具有强氧化性,能被金属还原生成二氧化硫,则Zn和浓硫酸发生氧化还原反应生成硫酸锌、二氧化硫和水,反应方程式为Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,故答案为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O;
(2)在金属活动性顺序表中,Zn位于H元素之前,所以锌和稀硫酸反应生成硫酸锌和氢气,反应方程式为Zn+H2SO4(稀)=ZnSO4+H2↑,
故答案为:Zn+H2SO4(稀)=ZnSO4+H2↑;
(3)①二氧化硫具有漂白性,能使品红溶液褪色,所以可以用品红溶液检验二氧化硫,故答案为:品红溶液;检验SO2;
②酸性高锰酸溶液能氧化二氧化硫导致酸性高锰酸钾溶液褪色,水溶液中含有水蒸气,影响氢气检验,为防止水蒸气干扰,用浓硫酸干燥气体,所以C中盛放浓硫酸,目的是吸收水蒸气,故答案为:浓H2SO4;吸收水蒸气;
③氢气具有还原性,能还原部分金属氧化物生成金属单质同时生成水,水可以用无水硫酸铜检验,所以C中试剂是CuO,空气中含有水蒸气,干扰氢气的检验,所以E中盛放碱石灰,目的是吸收水蒸气,
故答案为:CuO;防止空气中的水蒸气进入D装置;
(4)氢气具有还原性,能还原部分金属氧化生成水,水可以用无水硫酸铜检验,根据元素守恒知,气体X中含有氢气,看到的现象是:C中黑色固体变为红色,D中白色固体变为蓝色,故答案为:C中黑色固体变为红色,D中白色固体变为蓝色.
点评 本题考查性质实验方案设计,侧重考查学生实验基本操作、物质的性质、物质的检验等知识点,同时还考查学生思维的严密性,明确实验原理是解本题关键,知道每个装置的作用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该反应达到平衡时,放出的热量等于92.4KJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡不移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 样品中A的质量分数/% | 20 | 50 | 70 | 90 |
| 样品的质量损失/% | 7.4 | 18.5 | 25.9 | 33.3 |
| A. | 化合物A的摩尔质量为104g•mol-1 | |
| B. | 样品A的质量分数为55%,加热至400℃样品质量损失21.35% | |
| C. | 样品A加热后的气体能使品红褪色 | |
| D. | 16.8g化合物A加热至质量不变化后,剩余固体质量为10.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸液溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上小苏打溶液 | |
| C. | 在加热的情况下,试管中的液体体积不要超过试管容积的$\frac{3}{4}$ | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2 | B. | 5:5:4 | C. | 1:1:1 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com