
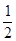 H2SO4(l)+NaOH(l)=
H2SO4(l)+NaOH(l)= 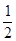 Na2SO4(l)+ H2O(l);△H=-57.3KJ/mol
Na2SO4(l)+ H2O(l);△H=-57.3KJ/mol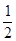 O2(g)= CO2(g);△H=-283KJ/mol
O2(g)= CO2(g);△H=-283KJ/mol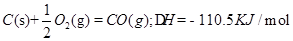 。(2分)
。(2分)


科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由“C(石)→C(金);△H=" +1.9" kJ/mol ”可知金刚石比石墨稳定 |
| B.在101KPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
| C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) = 2H2O(l);△H= -571.6kJ/mol |
| D.HCl和NaOH反应的中和热△H= -57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为△H= -(2×57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2CO2(g);△H=-566kJ/mol
2CO2(g);△H=-566kJ/mol  CO(g)+3H2(g);ΔH="+216" kJ/mol。下列叙述正确的是( )
CO(g)+3H2(g);ΔH="+216" kJ/mol。下列叙述正确的是( )| A.CO的燃烧热为-566kJ/mol |
| B.在③反应时,若加入催化剂,可以使ΔH减小 |
| C.若有3.2g CH4与足量水蒸气按③反应,则放出热量是43.2 kJ |
| D.若生成相同质量的CO2,则放出的热量C2H2大于CO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ· mol-1,则氢气的燃烧热为 241.8 kJ· mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4 kJ· mol-1 则含0.5mol NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.7kJ |
C.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=" a" kJ· mol-1、 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.44.8 L HF气体分解成22.4 L的H2和22.4 L的F2吸收270 kJ热量 |
| B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量大于270 kJ |
| C.相同条件下,1 molH2与1 molF2的能量总和低于2 molHF气体的能量 |
| D.断开2 mol H—F键所需要的能量比断开1 mol H—H键和1 mol F—F键所需要的能量之和大270 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳原子最外电子层有4个电子 | B.碳元素是非金属元素 |
| C.碳有多种同素异形体 | D.碳元素有三种同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com