
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T/℃ | NO初始浓度 mol?L-1 | CO初始浓度 mol?L-1 | 催化剂的比表面积 ㎡?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 124 |
| 催化剂 |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| 7.5×10-4mol/L |
| 2s |
| 1 |
| 2 |
| 实验编号 | T/℃ | NO初始浓度 mol?L-1 | CO初始浓度 mol?L-1 | 催化剂的比表面积 ㎡?g-1 |
| Ⅰ | 5.8×10-3 | 82 | ||
| Ⅱ | 280 | 5.80×10-3 | 124 | |
| Ⅲ | 1.20×10-3 | 5.80×10-3 | 124 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
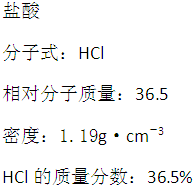 如图为实验室某浓盐酸试剂瓶的标签上的盐酸分子式:HCl相对分子质量:36.5密度:1.19g?cm-3HCl的质量分数:36.5%有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的盐酸分子式:HCl相对分子质量:36.5密度:1.19g?cm-3HCl的质量分数:36.5%有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、臭氧与氧气是氧元素的两种同素异形体,其物理性质相同 |
| B、打雷时、高压电机和复印机工作时均会产生臭氧 |
| C、臭氧能与Ag、Hg等与氧气不易反应的物质发生化学反应 |
| D、臭氧的密度大于空气,故臭氧主要集中在地面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com