
【题目】为了除去CO2气体中混有的SO2气体,下列有关仪器和药品的组合中,合理的是
①洗气瓶 ②干燥管 ③固态生石灰 ④苏打溶液 ⑤小苏打溶液
A. ①⑤ B. ②⑤ C. ①③ D. ①④
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中
(1)互为同分异构体的是________,
(2)互为同素异形体的是________,
(3)互为同位素的是________,
(4)属于同一物质的是________。
①C(CH3)4和C4H10
②![]() 和
和![]()
③35Cl和37Cl
④![]() H2O和
H2O和![]() H2O
H2O
⑤石墨和金刚石
⑥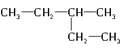 和
和![]()
⑦(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH3
⑧H2 D2 T2
⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
则x=___________。
化学键 | H-H | C-O | C三O | H-O | C-H |
E/(kJmol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
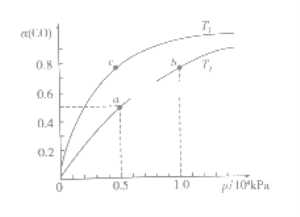
①T1_________T2(填“>”、“<”、“=”);a、b两点的反应速率:v(a)_____v(b)(填“>”、“<”、“=”);
在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是_____(填字母);
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
②计算图中a点的平衡常数KP=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
a:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
b:CO2(g)+H2(g)![]() CO(g)+H2O(g) H2
CO(g)+H2O(g) H2
c:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
①述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
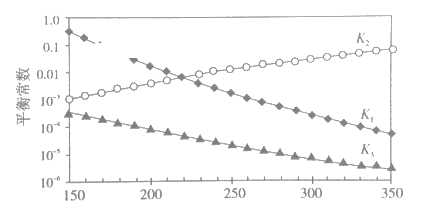
则H1__________H3(填“>”、“<”、“=”),理由是_______。
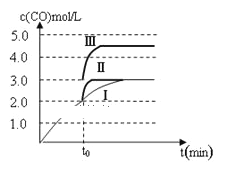
②一定温度下,在3 L容积可变的密闭容器中发生反应b,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_________。
③反应c的 △H___0, △S____0(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,断裂1molN≡N吸收942kJ热量.根据以上信息和数据,下列说法正确的是( )

A. N4属于一种新型的化合物,与N2互为同素异形体
B. N4的沸点比白磷(P4)的高
C. 1mol N4转化为2mol N2的同时放出能量
D. 相同质量的N4和 N2所含原子个数比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。

实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
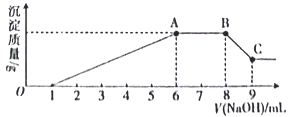
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酸雨”的形成主要是由于( )
A. 森林遭乱砍滥伐,破坏了生态平衡 B. 工业上大量燃烧含硫燃料
C. 大气中二氧化碳的含量增多 D. 汽车排出大量尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)流程中将高硫铝土矿磨成矿粉的目的是_________________________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
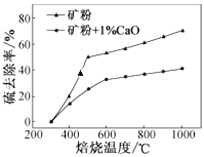
已知:多数金属硫酸盐的分解温度都高于600 ℃;硫去除率=(1—![]() )×100%。
)×100%。
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于____________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________。
(3)由“过滤”得到的滤液生产氧化铝的反应过程中涉及的离子方程式是______________________。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是
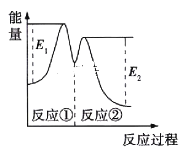
A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴已知油脂在水面上为单分子层,假设油脂的摩尔质量为M,每个油脂分子的横截面积为Acm3,取该油脂mg,配成体积为VmmL的油脂苯溶液,将该溶液滴加到表面积为Scm2的水中,若每滴溶液的体积为VdmL,当滴入第n滴油脂苯溶液时,油脂的苯溶液恰好在水面上不在扩散,则阿伏加德罗常数NA的数学表达式为NA=_______________。
⑵水面上铺一层油(常用十六醇、十八醇,只有单分子厚),在缺水地区的实际意义是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com