
【题目】下列关于单质的叙述正确的是( )
A.单质可以发生分解反应B.单质可以用化合反应制取
C.单质不参加复分解反应D.单质不可以通过化学反应制取
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)![]() CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:

(1)能判断反应达到化学平衡状态的是 (填字母)。
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E.v正(H2)=2 v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是 。
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),此正反应是________反应(填“放热或吸热”)。
(3)①反应Ⅰ在6 min时达到平衡,从反应开始到达到平衡时v (CH3OH) = mol/(L·min)。
②反应Ⅱ在2 min时达到平衡,计算该温度下的平衡常数K= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后,平衡将向_________(填“正反应、逆反应和不移动”),原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。

(1)加热前通入氮气的目的是_____________,操作方法为______________。
(2)装置A、C、D中盛放的试剂分别为A________,C________,D________。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将_______(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将________;若撤去E装置,则测得Na2CO3·10H2O的含量将________。
(4)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3的质量分数为_______(用含w、m1、m2的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示。 ,下列分析不正确的是
,下列分析不正确的是

A. ROH为弱碱
B. 若a=8,从A到B的过程中,水的电离程度逐渐减小
C. A点溶液c ( Cl-)=c (R+)
D. 若b=15,溶液中存在![]() c(Cl-)+c(ROH)+c(OH-)=c(H+)
c(Cl-)+c(ROH)+c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料。下列关于聚乙炔叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]() ,分子中所有碳原子在同一直线上
,分子中所有碳原子在同一直线上
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂自身不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。

实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是____________________。
(2)制备硝基苯的化学方程式_____________________。
(3)配制混合酸时,能否将浓硝酸加入到浓硫酸中_________(“是”或“否”),说明理由:____________________。
(4)为了使反应在50℃~60℃下进行,常用的方法是______________。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是_____________________。
(5)在洗涤操作中,第二次水洗的作用是_____________________。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_______________________。
(7)本实验所得到的硝基苯产率是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2(g)=2NO(g)。已知该反应过程中的能量变化如图所示,下列说法中错误的是( )
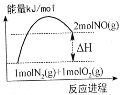
A. 该反应过程中有共价键的断裂和形成
B. 该反应是氧化还原反应
C. 该反应是放热反应
D. 使用催化剂可以改变反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种正投入生产的大型蓄电系统。放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是

A. 放电时,负极反应为3NaBr-2e-==NaBr3+2Na+
B. 充电时,阳极反应为2Na2S2-2e-== Na2S4+2Na+
C. 放电时,Na+经过离子交换膜,由b池移向a池
D. 用该电池电解饱和食盐水,产生2.24LH2时,b池生成17.40g Na2S4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com