
【题目】短周期五种元素 A、B、C、D、E,原子序数依次增大。已知:A 原子的核外电子数与电子层数相等;B 元素原子的核外 p 电子数比 s 电子数少 1 个;C 原子的第一至第四电离能为 I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1,I4=10 540 kJ·mol-1;D 原子核外所有 p 轨道为全充满或半充满;E 元素的族序数与周期序数的差为 4。
(1)写出 C 单质在 B 单质中燃烧的化学方程式:_______________________________________。
(2)某同学根据题目信息和掌握的知识分析 C 的核外电子排布为![]() 该同学所画的轨道式违背了_______________原理(或规则)。
该同学所画的轨道式违背了_______________原理(或规则)。
(3)用电子式表示 BA3 的形成过程:__________________________。
(4)DE3 中心原子杂化方式为_______________,其空间构型为_______________。
【答案】3Mg+N2![]() Mg3N2 能量最低原理
Mg3N2 能量最低原理 ![]() sp3 三角锥
sp3 三角锥
【解析】
短周期五种元素 A、B、C、D、E,原子序数依次增大。已知:A 原子的核外电子数与电子层数相等,则A为H元素;B 元素原子的核外 p 电子数比 s 电子数少 1 个,核外电子排布式为1s22s22p3,则B为N元素;C 原子的第一至第四电离能为 I1=738 kJ·mol-1,I2=1 451 kJ·mol-1,I3=7 733 kJ·mol-1,I4=10 540 kJ·mol-1,第三电离能剧增,原子最外层有2个电子,原子序数大于N元素,故C为Mg;D 原子核外所有 p 轨道为全充满或半充满,处于VA族,原子序数大于Mg,故D为P元素;E处于第三周期,E元素的主族序数与周期数的差为4,E处于第ⅦA族,故E为Cl元素。
(1)C为Mg,C单质在N2单质中燃烧生成氮化镁,化学方程式:3Mg+N2![]() Mg3N2 。故答案为:3Mg+N2
Mg3N2 。故答案为:3Mg+N2![]() Mg3N2 ;
Mg3N2 ;
(2)某同学根据题目信息和掌握的知识分析 C 的核外电子排布为![]() 该同学所画的电子排布图中3s能级未填充满,就填充能量更高的3p能级,违背了能量最低原理原理(或规则)。故答案为:能量最低原理;
该同学所画的电子排布图中3s能级未填充满,就填充能量更高的3p能级,违背了能量最低原理原理(或规则)。故答案为:能量最低原理;
(3)N最外层5个电子,与3个H原子形成三个共价键,达到8电子稳定结构,用电子式表示 NH3 的形成过程:![]() 。故答案为:
。故答案为:![]() ;
;
(4)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+![]() =4,含有1对孤对电子对,杂化轨道数为4,DE3 中心原子杂化方式为sp3,其空间构型为三角锥。故答案为:sp3;三角锥。
=4,含有1对孤对电子对,杂化轨道数为4,DE3 中心原子杂化方式为sp3,其空间构型为三角锥。故答案为:sp3;三角锥。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】等质量的碳酸钙与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如下图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
组别 | 对应曲线 | c(HCl) / mol·L-1 | 反应温度 / ℃ | 铁的状态 | |
1 | a | 30 | 粉末状 | ||
2 | b | 30 | 粉末状 | ||
3 | c | 2.5 | 块状 | ||
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢
B. 第1组实验中盐酸的浓度可能最大
C. 第2组实验中盐酸浓度可能等于2.5mol/L
D. 第3组实验的反应温度低于30 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______。
(2)H2的燃烧热为_______,C的燃烧热为_______。
(3)燃烧10 g H2生成液态水,放出的热量为_______。
(4)CO的燃烧热为_____________,其热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.过氧化钠的电子式是 Na+[:O:O:]2-Na+
B.原子最外层电子排布式为4s1和5s1 是同一主族元素
C.电负性差值大于 1.7 的化合物一定是离子化合物
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是H2O,配位数是 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率υ正<υ逆的是点1
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如下图所示的实验装置(固定装置已略去)。
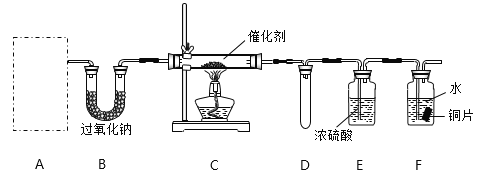
①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_______(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是___________________;装置D的作用是___________________。
③装置C中发生反应的化学方程式为________________________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_____________________________。
⑤该装置存在的主要缺陷是___________________________________________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图所示装置(其余部分相同)进行实验。
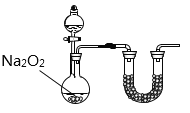
①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是___________,U型管中加入的试剂是___________。
②此装置能产生大量氨气的原因是___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
Ⅰ.探究一:备选药品:镁片、铝片、0.500 mol·L-1H2SO4、18.4 mol·L-1H2SO4。
甲同学研究的实验报告:
实验步骤 | 现象 | 结论 |
①用砂纸打磨镁片和铝片; ②分别取等体积等浓度的硫酸于两支试管中; ③将镁片和铝片同时投入到试管中。 | 金属的性质越活泼, 反应速率越快 |
(1)甲同学用砂纸打磨镁片和铝片的原因是______________________________;选择H2SO4浓度为________________。
(2) 实验报告中现象为_______________________________________________。
Ⅱ.探究二:实验室经常用Na2S2O3与H2SO4的反应探究化学反应速率的影响因素,利用图1所示装置(夹持装置略去)进行实验,观察到锥形瓶底部有淡黄色浑浊。
(3)请用化学方程式表示出实验原理_________________________________,乙同学在实验过程中对产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据并绘制出图像(如图2)。

0~20s内反应速率υ1=__________mL·s-1,80~100s内反应速率υ2=__________mL·s-1。不考虑实验测量误差,分析速率差异的主要原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中存在Cl2+H2O![]() H++Cl-+HClO,当加入AgNO3溶液后,溶液颜色变浅
H++Cl-+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.分别用等体积的蒸馏水和0.010mol/L硫酸洗涤BaSO4沉淀,后者损失的BaSO4沉淀少
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是一种短周期元索,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
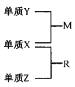
A. X元素位于周期表中第16列
B. X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物
C. X、Y、Z元素形成的单质均具有强还原性
D. R的沸点高于M的沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com