
【题目】常温下某H2CO3溶液的pH约为5.5,c (CO32-)约为5×10-11 mol/L,该溶液中浓度最低的离子是
A.HCO3-B.CO32-C.H+D.OH-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:![]() ΔH=-241.8kJ·mol-1
ΔH=-241.8kJ·mol-1
![]() ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。
(2)①在101 kPa时,H2(g)在 1.00 mol O2(g)中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为________________________________。
②1.00 L 1.00 mol·L1 H2SO4溶液与2.00 L 1.00 mol·L1 NaOH溶液完全反应,放出114.6 kJ热量,表示其中和热的热化学方程式为____________________________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
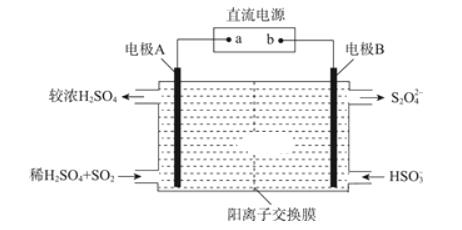
电极A的电极反应式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
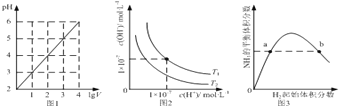

A.图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B.图2表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中b点N2的转化率小于a点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2-氯丁烷与乙醇溶液共热发生消去分子的反应
C. 甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D. 邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的结构简式可用![]() 来表示,下列关于苯的叙述中正确的是
来表示,下列关于苯的叙述中正确的是
A. 苯主要是以石油为原料而获得的一种重要化工原料
B. 苯中含有碳碳双键,所以苯属于烯烃
C. 苯分子中6个碳碳化学键完全相同
D. 苯可以与溴水、高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓄电池在充电时作电解池,放电时作原电池.如图是铅蓄电池的工作示意图,其反应原理为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O下列说法中错误的是( )
2PbSO4+2H2O下列说法中错误的是( )

A.b电极放电后转化为c电极
B.电极a和d都发生还原反应
C.b的电极反应式:Pb+SO42﹣﹣2e-→PbSO4
D.放电后硫酸溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组探究利用废铜屑制取CuSO4溶液,设计了以下几种实验方案。完成下列填空:
(1)方案一:以铜和浓硫酸反应制备硫酸铜溶液。方案二:将废铜屑在空气中灼烧后再投入稀硫酸中。和方案一相比,方案二的优点是________________________;方案二的实验中,发现容器底部残留少量紫红色固体,再加入稀硫酸依然不溶解,该固体为________。
(2)方案三的实验流程如图所示。
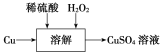
溶解过程中有气体放出,该气体是________。随着反应的进行,生成气体速率加快,推测可能的原因是________________________________________________________________________________。
(3)设计实验证明你的推测:______________________________。
方案四的实验流程如图所示。

(4)为了得到较纯净的硫酸铜溶液,硫酸和硝酸的物质的量之比应为________;
(5)对方案四进行补充完善,设计一个既能防止污染,又能实现物料循环的实验方案(用流程图表示)__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用![]() 可定量测定CO的含量,该反应原理为
可定量测定CO的含量,该反应原理为![]() ,其实验步骤如下:
,其实验步骤如下:
①取200 mL(标准状况)含有CO的某气体样品通过盛有足量![]() 的硬质玻璃管中在170℃下充分反应:
的硬质玻璃管中在170℃下充分反应:
②用酒精溶液充分溶解产物![]() ,配制100 mL溶液;
,配制100 mL溶液;
③量取步骤②中溶液20.00 mL于锥形瓶中,然后用![]() 的
的![]() 标准溶液滴定,发生反应为
标准溶液滴定,发生反应为![]() 。消耗标准
。消耗标准![]() 溶液的体积如表所示。
溶液的体积如表所示。
第一次 | 第二次 | 第三次 | |
滴定前读数/mL | 1.10 | 1.50 | 2.40 |
滴定后读数/mL | 21.00 | 21.50 | 22.50 |
(1)步骤②中配制100 mL待测液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和________。
(2)![]() 标准液应装在________(填“酸式”“碱式”)滴定管中。
标准液应装在________(填“酸式”“碱式”)滴定管中。
(3)指示剂应选用________,判断达到滴定终点的现象是________。
(4)气体样品中CO的体积分数为________(已知气体样品中其他成分不与![]() 反应)
反应)
(5)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点时仰视读数
b.滴定前尖嘴外无气泡,滴定后有气泡
C.配制100 mL待测溶液时,有少量溅出。
d.锥形瓶用待测溶液润洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com