
【题目】海水中含有MgCl2,从海水中提取镁,正确的方法是
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→ MgCl2(熔融)
MgCl2溶液→ MgCl2(熔融)![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液 → MgCl2(熔融)
MgCl2溶液 → MgCl2(熔融)![]() Mg
Mg
科目:高中化学 来源: 题型:
【题目】氧化还原反应在化学研究和工业生产中意义重大。在一定条件可发生如下两个氧化还原反应:
①Fe+ H2SO4(浓)![]() Fe2(SO4)3+ SO2↑+H2O(未配平)
Fe2(SO4)3+ SO2↑+H2O(未配平)
②3S+6KOH![]() 2K2S+ K2SO3+3H2O
2K2S+ K2SO3+3H2O
试回答下列问题:
(1)反应①中氧化产物为____________,当反应中生成标准状况下6.72LSO2气体时,被还原的H2SO4的物质的量为____________mol。
(2)反应②中,还原剂与氧化剂的物质的量之比为______________,若反应中有4.816×1023个电子发生转移时,消耗S的质量为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 Na2CO3 和 Na2S 按 1∶2 的物质的量之比配成溶液,再通入 SO2,可制取 Na2S2O3,同时放出CO2。在该反应中( )
A.被氧化与被还原的原子个数比为 2∶1
B.相同条件下,每吸收 1 m3 SO2 就会放出 2.5 m3 CO2
C.每 1 mol Na2S 反应,则生成的 Na2S2O3 为 1.5 mol
D.若有 106 g Na2CO3 发生反应,反应中转移的电子的物质的量为 4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用O2将HCl转化为Cl2,反应为:O2(g)+4HCl(g)![]() 2Cl2(g)+2H2O(g)。请完成下列填空:
2Cl2(g)+2H2O(g)。请完成下列填空:
(1)该反应化学平衡常数K的表达式为_____________________;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是_________反应(填“吸热”或者“放热”)。
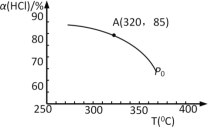
(2)写出一种能提高HCl转化率的方法___________________。
(3)上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线______,并简要说明理由:_________________。
(4)根据图中信息所示,在P0、320℃条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中n(HCl)=_____mol。
(5)氯元素能组成多种化合物,如常见的铵态氮肥,氯化铵溶液呈______性,其原因用离子方程式表示:___________________________。现有一瓶氯化铵、氯化钠和氨水的混合液,经测定溶液呈中性,此时三种离子的关系是:[Na+]+[NH4+]_____[Cl-](填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+* H)。下列说法错误的是
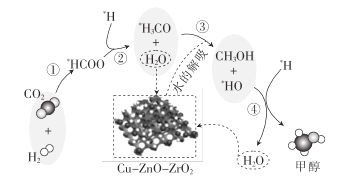
A.向该反应体系中加入少量的水能增加甲醇的收率
B.带*标记的物质是该反应历程中的中间产物
C.二氧化碳加氢制甲醇的过程中原子利用率达100%
D.第③步的反应式为*H3CO+ H2O→CH3OH+*HO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
A. Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
B. 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
C. 已知25 ℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=4.0×104
Fe3++3H2O的平衡常数K=4.0×104
D. 已知25 ℃时Ksp[Mg(OH)2] =1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
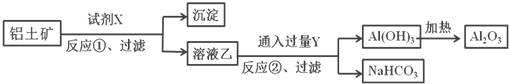
A. 反应①中试剂X是氢氧化钠溶液
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应中包含一个氧化还原反应
D. 将试剂X和Y进行对换,最终可以达到相同的效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com