
| 实验编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
| HX | HY | ||
| ① | 0 | 3 | m |
| ② | 10.00 | x | y |
| ③ | 20.00 | n | 7 |
| A. | 相同温度下.同浓度的两种酸溶液的导电能力:HX<HY | |
| B. | 表中x<7 | |
| C. | HX和HY的混合溶液中存在:c(H+)=c(X-)+c(Y-)+c(OH-) | |
| D. | 实验②NaOH与HY反应后的溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) |
分析 根据①氢氧化钠溶液体积为0时,0.1000mol/L的酸HX溶液的pH=3,说明HX为弱酸;
根据③20mL 0.1000mol/L的氢氧化钠溶液与20.00mL 0.1000mol/L的HY恰好反应生成NaY,溶液呈中性,说明HY为强酸;
A.根据分析可知HX为弱酸、HY为强酸,二者都是一元酸,浓度相等时强酸的导电能力大于弱酸;
B.加入10mL等浓度的氢氧化钠溶液时,反应后溶质为等浓度的NaX、HX,分别计算出HX的电离平衡常数、X-的水解是水解平衡常数,根据计算结构判断HX的电离程度与X-的水解程度的大小即可;
C.根据混合液中的核电荷数判断;
D.实验②NaOH与HY反应后溶质为等浓度的NaY、HY,HY为强电解质,氢离子还来自水的电离,则c(H+)>c(Na+).
解答 解:根据①氢氧化钠溶液体积为0时,0.1000mol/L的酸HX溶液的pH=3,说明HX为弱酸;根据③20mL 0.1000mol/L的氢氧化钠溶液与20.00mL 0.1000mol/L的HY恰好反应生成NaY,溶液呈中性,说明HY为强酸,
A.HX为弱酸、HY为强酸,且二者都是一元酸,强酸完全电离、弱酸部分电离,则相同温度下同浓度的两种酸溶液的导电能力:HX<HY,故A正确;
B.②中加入10mL等浓度的氢氧化钠溶液时,反应后溶质为等浓度的NaX、HX,HX的电离平衡常数约为K=$\frac{1×1{0}^{-3}×1×1{0}^{-3}}{0.1}$=1×10-5,X-的水解平衡常数Kh=$\frac{{K}_{W}}{K}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-5}}$=1×10-9,说明浓度相等时HX的电离程度大于X-的水解程度,则混合溶液呈酸性,则x<7,故B正确;
C.根据电荷守恒可知,HX和HY的混合溶液中满足:c(H+)=c(X-)+c(Y-)+c(OH-),故C正确;
D.实验②NaOH与HY反应后溶质为等浓度的NaY、HY,HY为强电解质,则c(Y-)的离子浓度最大,氢离子还来自水的电离,则c(H+)>c(Na+),溶液中正确的离子浓度大小为:c(Y-)>c(H+)>c(Na+)>c(OH-),故D错误;
故选D.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,正确判断HX是弱电解质、HY是强弱电解质为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的综合应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| B. | 氯气与氢氧化钾溶液反应:Cl2+OH-═Cl-+ClO-+2H2O | |
| C. | 硫酸铝与氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 小苏打溶液与稀盐酸反应:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | F2与NaOH溶液反应:F2+4OH-═2F-+O2+2H2O | |
| C. | AgNO3溶液中加入少量氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径R>W>Y>Z | |
| B. | 气态氢化物稳定性:HmW<HnR | |
| C. | Z2Y2电子式可表示为  | |
| D. | RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
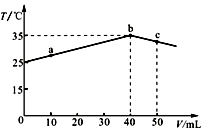
| A. | a→b的过程中,溶液中c(A-)与c(HA)之和始终不变 | |
| B. | b点表示酸碱恰好完全反应 | |
| C. | 等浓度的NaOH和NaA混合溶液中一定存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 25℃时,HA的电离平衡常数Ka约为1.23×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 终点溶液偏碱性 | B. | 终点溶液中c(NH4+)=c(Cl-) | ||
| C. | 终点溶液中氨过量 | D. | 合适的指示剂是甲基橙而非酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CH2C12含极性共价键数目为2NA | |
| B. | 含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目大于NA | |
| C. | 4.6g甲苯(C7H8)和丙三醇(C3H8O3)混合物中含H原子数目为0.4NA | |
| D. | 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石>晶体桂>碳化硅 | B. | Na>Mg>Al | ||
| C. | NaF<NaCl<NaBr | D. | CI4>CBr4>CCl4>CH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com