
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
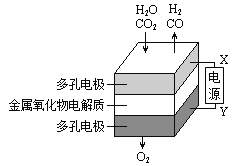
A.阴、阳两极生成的气体的物质的量之比是1︰2
B.X是电源的负极
C.阴极的反应式是:H2O+2e-=H2+O2- CO2+2e-=CO+O2-
D.总反应可表示为:H2O+CO2![]() H2+CO+O2
H2+CO+O2
【答案】A
【解析】
A.从总反应方程式可知,阴极生成2mol气体(H2、CO各1mol)、阳极生成1mol气体(氧气),所以阴、阳两极生成的气体物质的量之比2∶1,故A错误;
B.从图示可看出,与X相连的电极发生H2O→H2、CO2→CO的转化,均得电子,应为电解池的阴极,则X为电源的负极,故B正确;
C.阴极H2O→H2、CO2→CO均得电子发生还原反应,电极反应式分别为:H2O+2eˉ=H2↑+O2ˉ、CO2+2eˉ=CO+O2ˉ,故C正确;
D.从图示可知,阳极生成H2和CO的同时,阴极有O2生成,所以总反应可表示为:H2O+CO2![]() H2+CO+O2,故D正确。
H2+CO+O2,故D正确。
综上所述,答案为A。


科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.Cu2(OH)2CO3(s)![]() CuCl2(aq)
CuCl2(aq)![]() Cu(s)
Cu(s)
B.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)
D.SiO2(s)![]() SiCl4(l)
SiCl4(l)![]() Si(s)
Si(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
氮原子可以形成 σ 键、π 键、大 π 键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下 列问题:
(1)第一电离能:氮______氧(填“大于”或“小于”),基态氮原子价电子排布图不是![]() ,是因 为该排布方式违背了__________。
,是因 为该排布方式违背了__________。
(2)肼(H2NNH2)分子中孤电子对与 σ 键的数目之比为______,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是______。
( 3)硝酸的结构可表 示 为 ![]() ,硝酸与水分子可 形 成一水合二硝酸结晶 水 合物 (2HNO3 H2O) , 水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______(氢键用“…”表示)。
,硝酸与水分子可 形 成一水合二硝酸结晶 水 合物 (2HNO3 H2O) , 水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______(氢键用“…”表示)。
(4)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①Na3NO4 阴离子的空间构型为______,其中心原子杂化方式为______。
②分别写出一种与 Na3NO4 的阴离子互为等电子体的阴离子和分子______(填化学式)。
③在 573 K 条件下,实验室中用 NaNO3 和 Na2O 在银皿中反应制得 Na3NO4,Na2O 的立方晶胞如图所 示。

图中“●”表示______(填“Na+”或“O2”),距离“●”最近且等距离的“○”有______个,Na2O 晶胞的参数为 a pm,则晶胞密度为_____gcm3。(列出计算式即可,NA 为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。

已知:![]() +H2O
+H2O

(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______,导管B除了导气外还具有的作用是_______________________。
②试管C置于冰水浴中的目的是_______________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层(填“上”或“下”),分液后用__________(填编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_____口进入(填“f”或“g”)。蒸馏时要加入生石灰,目的是____________________________________。

③收集产品时,控制的温度应在_______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________(填字母序号,下同)。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A.通入CO后,正反应速率逐渐增大
B.升高温度,H2S浓度增加,表明该反应是吸热反应
C.CO的平衡转化率为80%
D.反应前H2S物质的量为7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微粒M和N,肯定属于同族元素且化学性质相似的是( )
A.结构示意图:M为![]() ,N为
,N为![]()
B.原子核外电子排布式:M为1s22s2,N为1s2
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
B.CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
C.PO43-+H3O+ ![]() HPO42-+H2O
HPO42-+H2O
D.H2O+H2O![]() H3O++OH-
H3O++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)=SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是 ___。
(2)铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,请写出其水解反应化学方程式____。LiAlH4在化学反应中通常作_______(填“氧化”或“还原”)剂。工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为 _________
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
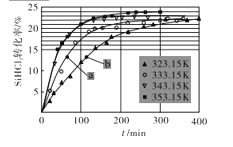
①353.15K时,平衡转化率为____,该反应是____反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的最佳措施是____。
(4)比较a、b处反应速率的大小:Va ___Vb (填“>”“<”或“=”)。已知反应速率V正=K1x2SiHCl3,V逆=K2xSiH2Cl2xSiCl4,K1,K2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时K1/K2 =____(保留3位小数)。
(5)硅元素最高价氧化物对应的水化物是H2SiO3,室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是 ___,其原因是____。已知:H2SiO3 :Ka1=2.0×10-10、Ka2=2.0×10-12、H2CO3 :Ka1=4.3×10-7,Ka2=5.6×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对溴苯乙烯(![]() )与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。完成下列填空:
)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。完成下列填空:
(1)写出该共聚物的结构简式___________。
(2)实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体![]() 。写出该两步反应所需的试剂及条件____________,____________。
。写出该两步反应所需的试剂及条件____________,____________。
(3)将![]() 与氢氧化钠溶液共热得到A
与氢氧化钠溶液共热得到A![]() ,写出上述反应的条件___________;由上述反应,关于卤代烃水解反应你可以得到的结论为__________________;写出A生成对溴苯乙烯的反应的化学方程式_______________。
,写出上述反应的条件___________;由上述反应,关于卤代烃水解反应你可以得到的结论为__________________;写出A生成对溴苯乙烯的反应的化学方程式_______________。
(4)以1,3-丁二烯为原料制备工程塑料PB的原料之一的l,4-丁二醇(BDO)的合成路线:C4H6![]() C4H6Cl2
C4H6Cl2![]()
![]() BDO。写出上述由A制备BDO的化学方程式:
BDO。写出上述由A制备BDO的化学方程式:
①反应④________
②反应⑤________
③反应⑥________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com