
(15分)高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。电解法制备高铁酸钾操作简便,成功率高,易于实验室制备。其原理如下图所示。
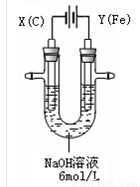
I. 实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(1)电解过程中,X极是 极,电极反应是 。
(2)电解过程中,Y极放电的有 。
(3)生成高铁酸根(FeO42-)的电极反应是 。
II. 若用不同种电池作为上述实验的电源,请分析电池反应。
(1)铅蓄电池总的化学方程式为:
2H2O+2PbSO4 Pb+PbO2+2H2SO4,则它在充电时的阳极反应为
Pb+PbO2+2H2SO4,则它在充电时的阳极反应为
。
(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH--2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为 。
(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料。已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气和液态水,放出624kJ的热量,则N2H4完全燃烧的热化学方程式是 ;
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是 。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O。
写出该电池正极的电极反应: 。
(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是 。
Ⅰ.(1)阴;2H++2e-= H2↑。(2)Fe和OH- (3)Fe+8OH--6e-= FeO42-+4H2O
Ⅱ.(1)PbSO4+2H2O-2e-= PbO2+SO42-+4H+
(2)Cd+2NiOOH+2H2O = Cd(OH)2+2Ni(OH)2
(3)N2H4(1)+O2(g)= N2(g)+2H2O(l) △H=-624kJ/mol
N2H4+4OH--4e-= 4H2O+N2↑
(4)O2+2CO2+4e-= 2CO32-
(5)10:10:5:1
【解析】I.(1)X和电源的负极相连,所以是阴极,溶液中的氢离子放电,方程式为2H++2e-= H2↑。
(2)Y和电源的正极相连,作阳极。由于Y是铁,所以铁失去电子,发生氧化反应。根据实验现象可判断,在阳极上溶液中的OH-也放电生成氧气。
(3)阳极铁失去电子,氧化产物是高铁酸根,反应式为Fe+8OH--6e-= FeO42-+4H2O。
II.(1)充电相当于电解,在电解池中阳极失去电子,发生氧化反应。根据反应式可判断,充电时硫酸铅失去电子,所以电极反应式为PbSO4+2H2O-2e-= PbO2+SO42-+4H+。
(2)在原电池中正负极的电极反应式相叠加即得到总反应式,所以反应式为Cd+2NiOOH+2H2O = Cd(OH)2+2Ni(OH)2。
(3)32.0g N2H4是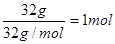 ,所以热化学方程式为N2H4(1)+O2(g)= N2(g)+2H2O(l) △H=-624kJ/mol。在燃料电池中负极是失去电子的,所以肼在负极通入,发生氧化反应,氧化产物是氮气,反应式为N2H4+4OH--4e-= 4H2O+N2↑。
,所以热化学方程式为N2H4(1)+O2(g)= N2(g)+2H2O(l) △H=-624kJ/mol。在燃料电池中负极是失去电子的,所以肼在负极通入,发生氧化反应,氧化产物是氮气,反应式为N2H4+4OH--4e-= 4H2O+N2↑。
(4)负极通入丙烷,丙烷的氧化产物是CO2和水,由于电解质水熔融的碳酸盐,所以电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,根据总反应式可知,正极反应式为5O2+10CO2+20e-= 10CO32-。
(5)1molPb、Cd、肼、丙烷失去的电子分别为2mol、2mol、4mol、20mol,所以根据得失电子守恒可知,Pb、Cd、肼、丙烷的物质的量之比是10:10:5:1。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com