
| A. | 5.6gFe溶于1L 0.3moL/L硝酸中,转移的电子数为0.3NA | |
| B. | 冰晶体中平均每摩尔水分子最多含有2NA个氢键 | |
| C. | 12g石墨层状结构中含有平面正六边形的数目为NA | |
| D. | 1molN2和3molH2在一定条件下充分反应形成的N-H键数目为6NA |
分析 A.求出铁和硝酸的物质的量,然后根据铁与稀硝酸反应时,当铁变为+2价时,消耗硝酸的量最少,此时3molFe~8mol硝酸来分析;
B.根据均摊法计算平均每摩尔水分子中含有得氢键数;
C.12g石墨为1molC,平均一个C为三个六面体所用,根据均摊法计算;
D.合成氨的反应为可逆反应,不能进行彻底.
解答 解:A.5.6g铁的物质的量为0.1mol,而硝酸的物质的量n=CV=0.3mol/L×1L=0.3mol,而铁与稀硝酸反应时,当铁变为+2价时,消耗硝酸的量最少,此时3molFe~8mol硝酸,故硝酸不足,铁过量,故转移的电子小于0.2NA个,故A错误;
B.冰晶胞与金刚石晶胞类似,每1个水分子形成两个氢键,所以每摩尔水分子最多含有2mol氢键,即2NA个氢键,故B正确;
C.12g石墨为$\frac{12g}{12g/mol}$=1mol,即含有NA个C,根据均摊法,一个C为三个环所用,则一个C占$\frac{1}{3}$,因此一个六元环中含有的C为$6×\frac{1}{3}=2$,则NA个C含有的六元环数目为0.5NA,故C错误;
D.合成氨的反应为可逆反应,不能进行彻底,故1mol N2和3molH2,在一定条件下充分反应,生成的氨气的物质的量小于2mol,则形成的N-H键的数目小于6NA个,故D错误.
故选B.
点评 本题考查阿伏伽德罗常数的计算,B和C为易错点和难点,考查的是晶胞知识,注意均摊法的利用.题目难度中等,是中档题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O | |
| B. | 向含1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时的反应:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加少量的稀盐酸:6Br-+2NO3-+8H+=3Br2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
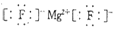 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.
如图的转化关系中,已知A是由短周期元素组成的盐,H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水 | B. | 氯化铁溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色固体粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL 0.1mol/L MgCl2溶液 | B. | 100mL 0.5mol/L AlCl3溶液 | ||
| C. | 50mL1mol/L NaCl溶液 | D. | 25mL 0.5mol/L HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com